题目内容
【题目】氢气是一种理想的绿色能源.利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景.乙醇水蒸气重整制氢的部分反应过程如图所示:
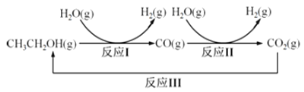
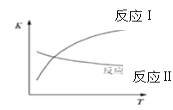
已知:反应I和反应II的平衡常数随温度变化曲线如图所示。
(1)反应I中,1molCH3CH2OH(g)参与反应后的热量变化是256kJ。
①反应II的△H___0(填“<”“=”或“>”)。
②反应I的热化学方程式是____。
(2)反应II,在进气比[n(CO):n(H2O)]不同时,测得相应的CO的平衡转化率见下图(各点对应的反应温度可能相同,也可能不同)。

①图中D、E两点对应的反应温度分别为TD和TE.判断:TD______TE(填“<”“=”或“>”)。
②经分析,A、E和G三点对应的反应温度相同,其原因是A、E和G三点对应的______相同.
③当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是______。
(3)反应III,在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如图所示。
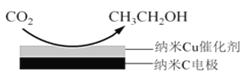
①电解活化CO2制备乙醇化学方程式是_____。
②从电解后溶液中分离出乙醇的操作方法是_____。
【答案】< CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g)△H=+256kJmol-1 < 化学平衡常数 进气比越大,反应温度越低 14CO2+12e-+9H2O=CH3CH2OH+12HCO3- 蒸馏
【解析】
(1)①由平衡常数随温度变化曲线图可知,温度升高,反应II的平衡常数减小,说明升高温度,平衡向逆向移动,因此反应II为正向放热的反应,即△H<0,
答案为:<;
②由平衡常数随温度变化曲线图可知,温度升高,反应Ⅰ的平衡常数增大,说明升高温度,平衡向正向移动,因此反应Ⅰ为正向吸热的反应,即△H>0,根据反应前后能量变化,则反应Ⅰ的热化学方程式为:CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g)△H=+256kJmol-1,
答案为:CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g)△H=+256kJmol-1
(2)①由平衡常数随温度变化曲线图可知,温度升高,反应Ⅱ的平衡常数减小,说明升高温度,平衡正向进行程度减小,平衡逆向移动,因此反应Ⅱ为正向放热的反应。当CO和H2O物质的量之比相等时,CO的转化率:D>E,说明由TD到TE,反应逆向移动,则TD到TE温度升高,即TD<TE;
答案为:<;
②某一可逆反应的化学平衡常数K只受温度影响,温度保持不变,改变影响化学平衡的其它条件时,平衡可能发生移动,但K值不变。因此要说明A、E和G三点在反应物浓度不同的情况下温度相同,依据是其化学平衡常数相同;
答案为:化学平衡常数;
③由上一问题干已知,A、E和G三点反应温度相同,即![]() 。由图可知,B、E、F三点进气比:
。由图可知,B、E、F三点进气比:![]() ,但CO转化率相同,符合题干条件。TA到TB,CO转化率降低,反应逆向移动,因此TA>TB;同理,TF到TG,CO转化率降低,反应逆向移动,可得TG>TF,因此得出:
,但CO转化率相同,符合题干条件。TA到TB,CO转化率降低,反应逆向移动,因此TA>TB;同理,TF到TG,CO转化率降低,反应逆向移动,可得TG>TF,因此得出:![]() ,即当不同的进气比达到相同的CO平衡转化率时,进气比越大,反应温度越低。
,即当不同的进气比达到相同的CO平衡转化率时,进气比越大,反应温度越低。
答案为:进气比越大,反应温度越低;
(3)①阴极得电子,发生还原反应,元素化合价降低,CO2中碳元素为+4价,乙醇中碳元素平均化合价为-2价,为了维持电荷守恒,生成物还有HCO3-,HCO3-中的氢元素可从H2O中获得,则阴极的电极反应式为:14CO2+12e-+9H2O=CH3CH2OH+12HCO3-;
答案为:14CO2+12e-+9H2O=CH3CH2OH+12HCO3-;
②与水溶液相比,乙醇易挥发,沸点较低,可采用蒸馏的方法从电解液中分离出乙醇。
答案为:蒸馏。

 阅读快车系列答案
阅读快车系列答案【题目】为探究Na与CO2反应产物,某化学兴趣小组按如图装置进行实验。己知:CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3。
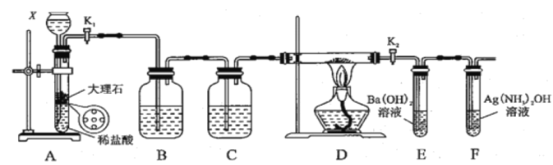
回答下列问题:
(1)写出A中反应的离子方程式__________;
(2)仪器X的名称是_______,B中的溶液为_________;
(3)先称量硬质玻璃管的质量为mlg,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g。再进行下列实验操作,其正确顺序是_____(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入CO2至E中出现浑浊 e.称量硬质玻璃管
f.冷却到室温重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
(4)加热硬质玻璃管一段时间,观察到以下现象:①钠块表面变黑,熔融成金属小球;②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;③F中试管内壁有银白物质产生。产生上述②现象的原因是________;
(5)探究固体产物中元素Na的存在形式
假设一:只有Na2CO3;
假设二:只有Na2O;
假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中__________; 现象:_________。 |
(6)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式____。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |