题目内容
2.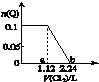 向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )
向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )| A. | Q是I- | |
| B. | Q是Br- | |
| C. | ab区间的反应:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | b点时溶液中只有Cl- |
分析 离子还原性I->Fe2+>Br-,故首先发生反应:2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,最后发生反应2Br-+Cl2=Br2+2Cl-,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积,据此判断.
解答 解:离子还原性I->Fe2+>Br-,故首先发生反应:2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,最后发生反应2Br-+Cl2=Br2+2Cl-,
A.若Q是I-,2I-+Cl2=I2+2Cl-,0.1molI-完全反应消耗0.05mol氯气,标准状况下为1.12L,此时碘离子为0,而图象中通入氯气为1.12L时,碘离子仍为0.1mol,与实际不符合,故A错误;
B.若Q是Br-,I-、Fe2+完全反应后,才发生2Br-+Cl2=Br2+2Cl-,0.1molI-完全反应消耗0.05mol氯气,0.1molFe2+完全反应消耗0.05mol氯气,故开始反应时氯气的体积为2.24L,图象中氯气的体积不符合,故B错误;
C.离子还原性I->Fe2+>Br-,故首先发生反应:2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,0.1molI-完全反应消耗0.05mol氯气,开始反应时氯气的体积为1.12L,0.1molFe2+完全反应消耗0.05mol氯气,此时氯气的体积为2.24L,所以ab区间的反应:2Fe2++Cl2═2Fe3++2Cl-,故C正确;
D.根据C可知:b点时溶液中有Cl-,Fe3+、Br-,故D错误;
故选C.
点评 本题以图象形式考查氧化还原反应、有关离子反应计算等,题目难度中等,确定离子反应发生的先后顺序是解题的关键.

| A. | 甲苯与硝酸发生取代反应生成三硝基甲苯 | |
| B. | 甲苯能使热的酸性高锰酸钾溶液褪色 | |
| C. | 甲苯燃烧时产生带浓烈黑烟的火焰 | |
| D. | 1mol甲苯最多能与3mol氢气发生加成反应 |
| A. | 20℃时,1mol SO2的体积一定大于22.4L | |
| B. | 常温常压下,1mol CO2与18 g H2O所含有的原子总数均为3 NA | |
| C. | 1mol/LNaCl溶液表示1L水中含有NaCl 58.5g | |
| D. | 标准状况下,11.2L NO与5.6 L O2形成的混合气体中含有的分子数为0.5NA |
| A. | H + NO3- Fe 2+ Na + | B. | Ag + NO3- Cl - K + | ||
| C. | K + Ba 2+ OH - SO42- | D. | Cu 2+ NH4+ Br - OH - |
| A. | 熔点:青铜>铜 | B. | 热稳定性:NaHCO3>Na2CO3 | ||
| C. | 酸性:H2SiO3>H2CO3 | D. | 氧化性:Cl2>12 |

| A. | 铊元素的质量数是81 | B. | 铊原子的电子数为3 | ||
| C. | 铊原子的相对原子质量是204.4 | D. | 铊的金属性比铝的金属性强 |
 半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)中一种重要的掺杂剂.实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)中一种重要的掺杂剂.实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5和HCl,遇o2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| PCl5 | 2 | 105.3 |
(1)装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O
(2)B中的试剂是浓硫酸,E中次冷水的作用是防止PCl3挥发(冷凝),F中碱石灰的作用是吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止黄磷(白磷)自燃通过控制K1、K2能除去A、B装置中的空气,具体的方法是先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2
(4)粗产品含有POCl3、PCl3等,加入黄磷加热除去PCl5,通过蒸馏(填实验操作的名称),即可得到纯净的PCl3
(5)通过下面方法可测定产品中PCl3的质量分数.
①迅速称取100g产品,加水反应后配成250mL溶液;
②取以上溶液25.0mL,向其中加入0.1mol 10mL碘水,充分反应;③向②所得溶液中加入几滴淀粉溶液,用0.1mol/L的Na2S2O3溶液滴定,滴定终点现象是溶液由蓝色变为无色,且半分钟内不变色
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL.已知H3PO3+H2O+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2SO4根据以上数据,该产品中PC3的质量分数是0.8%.
