题目内容
7.下列各组物质的性质比较中,正确的是( )| A. | 熔点:青铜>铜 | B. | 热稳定性:NaHCO3>Na2CO3 | ||
| C. | 酸性:H2SiO3>H2CO3 | D. | 氧化性:Cl2>12 |
分析 A、合金的熔点通常低于其成分金属;
B、碳酸氢钠受热易分解;
C、元素的非金属性越强,最高价含氧酸的酸性越强;
D、同一主族,随着原子序数的增大,非金属性逐渐减弱,单质的氧化性逐渐减弱.
解答 解:A、合金的熔点通常低于其成分金属,故青铜的熔沸点应该比铜低,故A错误;
B、碳酸氢钠受热易分解,而碳酸钠受热不易分解,故热稳定性:NaHCO3<Na2CO3,故B错误;
C、同一主族,从上而下,非金属性逐渐减弱,故非金属性Si<C,而元素的非金属性越弱,最高价含氧酸的酸性越弱,故酸性:H2SiO3<H2CO3,故C错误;
D、同一主族,随着原子序数的增大,非金属性逐渐减弱,单质的氧化性逐渐减弱,故氧化性氯气大于碘,故D正确.
故选D.
点评 本题考查了合金的性质、碳酸盐和碳酸氢盐的稳定性强弱比较和非金属性的强弱比较,难度不大,注意基础的掌握.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
17.纯碱是常用的化工原料,该物质不属于下列物质类别中的( )
| A. | 钠盐 | B. | 碱 | C. | 碳酸盐 | D. | 无机物 |
18.某物质结构简式如右图所示,下列有关该物质的说法不正确的是( )


| A. | 该物质分子式为C13H14O4 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 在一定条件下可发生加成、取代、消去反应 | |
| D. | 1 mol该物质最多能与2mol NaOH反应 |
2.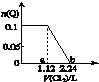 向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )
向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )
 向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )
向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )| A. | Q是I- | |
| B. | Q是Br- | |
| C. | ab区间的反应:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | b点时溶液中只有Cl- |
12.互为同位素的两种原子不可能具有( )
| A. | 相同的电子数 | B. | 相同的中子数 | ||
| C. | 几乎完全相同的化学性质 | D. | 相同的质子数 |
4.我校学生用中和滴定法测定某NaOH溶液的物质的量浓度.
(1)盛装0.2000mol/L盐酸标准液应该用酸式滴定管.
(2)当接近滴定终点时,很少量的碱或酸就会引起溶液的pH发生突变.
(3)有关数据记录如下:
则NaOH溶液的物质的量浓度为0.2mol/L.
(4)若只用蒸馏水冲洗锥形瓶,则测定结果无影响(填“无影响”、“偏高”或“偏低”).
(5)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是偏高.
(1)盛装0.2000mol/L盐酸标准液应该用酸式滴定管.
(2)当接近滴定终点时,很少量的碱或酸就会引起溶液的pH发生突变.
(3)有关数据记录如下:
| 实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.20 |
(4)若只用蒸馏水冲洗锥形瓶,则测定结果无影响(填“无影响”、“偏高”或“偏低”).
(5)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是偏高.
