题目内容
19.下面是一个合成反应的流程图: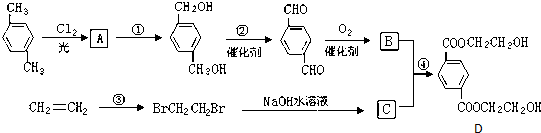
(1)请写出A、B、C的结构简式
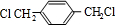 、
、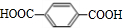 、HOCH2CH2OH.
、HOCH2CH2OH.(2)请写出①的化学方程式并标明反应的类型
 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$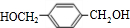 +2NaCl;水解(取代)反应.
+2NaCl;水解(取代)反应.(3)请写出
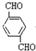 与银氨溶液反应的化学方程式OHCC6H4CHO+4Ag(NH3)2OH$\stackrel{水浴加热}{→}$NH4OOCC6H4COONH4+4Ag↓+6NH3↑+2H2O.
与银氨溶液反应的化学方程式OHCC6H4CHO+4Ag(NH3)2OH$\stackrel{水浴加热}{→}$NH4OOCC6H4COONH4+4Ag↓+6NH3↑+2H2O.(4)请写出 D的同分异构体F(
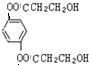 )与足量NaOH溶液反应的化学方程式:
)与足量NaOH溶液反应的化学方程式: +4NaOH→
+4NaOH→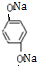 +2HOCH2CHCOONa.
+2HOCH2CHCOONa.
分析 对二甲苯与氯气在光照条件下发生侧链上取代反应生成A,A在氢氧化钠水溶液、加热条件下发生水解反应生成 ,可知A的结构简式为
,可知A的结构简式为 ,
, 在Cu或Ag作催化剂条件下,发生催化氧化生成
在Cu或Ag作催化剂条件下,发生催化氧化生成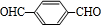 ,
, 发生氧化反应生成B为
发生氧化反应生成B为 .乙烯与溴发生加成反应生成BrCH2CH2Br,BrCH2CH2Br发生水解反应生成C为HOCH2CH2OH,对苯二甲酸与乙二醇发生酯化反应生成D,据此解答;
.乙烯与溴发生加成反应生成BrCH2CH2Br,BrCH2CH2Br发生水解反应生成C为HOCH2CH2OH,对苯二甲酸与乙二醇发生酯化反应生成D,据此解答;
解答 解:对二甲苯与氯气在光照条件下发生侧链上取代反应生成A,A在氢氧化钠水溶液、加热条件下发生水解反应生成 ,可知A的结构简式为
,可知A的结构简式为 ,
, 在Cu或Ag作催化剂条件下,发生催化氧化生成
在Cu或Ag作催化剂条件下,发生催化氧化生成 ,
, 发生氧化反应生成B为
发生氧化反应生成B为 .乙烯与溴发生加成反应生成BrCH2CH2Br,BrCH2CH2Br发生水解反应生成C为HOCH2CH2OH,对苯二甲酸与乙二醇发生酯化反应生成D,
.乙烯与溴发生加成反应生成BrCH2CH2Br,BrCH2CH2Br发生水解反应生成C为HOCH2CH2OH,对苯二甲酸与乙二醇发生酯化反应生成D,
(1)根据上面的分析可知,A为 ,B为
,B为 ,C为HOCH2CH2OH,
,C为HOCH2CH2OH,
故答案为: ;
; ;HOCH2CH2OH;
;HOCH2CH2OH;
(2)①的化学方程式为 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$ +2NaCl,该反应为水解(取代)反应,
+2NaCl,该反应为水解(取代)反应,
故答案为: +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$ +2NaCl;水解(取代)反应;
+2NaCl;水解(取代)反应;
(3) 与银氨溶液反应的化学方程式为OHCC6H4CHO+4Ag(NH3)2OH$\stackrel{水浴加热}{→}$NH4OOCC6H4COONH4+4Ag↓+6NH3↑+2H2O,
与银氨溶液反应的化学方程式为OHCC6H4CHO+4Ag(NH3)2OH$\stackrel{水浴加热}{→}$NH4OOCC6H4COONH4+4Ag↓+6NH3↑+2H2O,
故答案为:OHCC6H4CHO+4Ag(NH3)2OH$\stackrel{水浴加热}{→}$NH4OOCC6H4COONH4+4Ag↓+6NH3↑+2H2O;
(4)D的同分异构体F( )与足量NaOH溶液发生水解反应,反应的化学方程式为:
)与足量NaOH溶液发生水解反应,反应的化学方程式为: +4NaOH→
+4NaOH→ +2HOCH2CHCOONa,
+2HOCH2CHCOONa,
故答案为: +4NaOH→
+4NaOH→ +2HOCH2CHCOONa;
+2HOCH2CHCOONa;
点评 本题考查有机物推断与合成、有机反应类型、有机反应方程式书写等,注意充分利用转化关系中有机物结构进行推断,掌握官能团的性质是关键,难度中等.

 阅读快车系列答案
阅读快车系列答案(1)将水蒸气通过红热的炭即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1.
①该反应自发进行的外界条件是较高温度.
②在一个恒容的密闭容器中,一定温度下发生上述反应,下列能判断该反应达到化学平衡状态的是BC (填相应的编号).
A.CO和H2的体积分数相同
B.1mol H-H键断裂的同时断裂2mol H-O键
C.容器中的压强不变
D.消耗H2O的速率等于生成H2的速率
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,在催化剂存在下进行反应:
CO(g)+H2O(g)?H2(g)+CO2(g),得到如表中二组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| CO | H2O | H2 | CO | ||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 |
②计算实验2条件下平衡常数的值K=0.17.
(3)pKa表示的是弱电解质电离平衡常数的负对数,即pKa=-lgKa,有关数据如图:
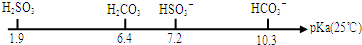
①0.01mol•L-1NaHSO3溶液的pH=bl,0.01mol•L-1NaHCO3溶液的pH=b2,则b1<b2(填“>”、“<”或“=”).
②向10mL 0.01mol•L-1的H2SO3溶液中,滴加0.0l mol•L-1KOH溶液10mL,溶液中存在c(H+)>c(OH-),则以下四种微粒K+、H2SO3、HSO3-、SO32-,其浓度由大到小的顺序为c(K+)>c(HSO3-)>c(SO32-)>c(H2SO3).
| A. | 生物质能来源于植物及其加工产品所贮存的能量,绿色植物通过光合作用将化学能转化为生物质能 | |
| B. | 用氨水法处理燃煤烟气中的二氧化硫,即可消除其污染,又可得到副产品硫酸铵 | |
| C. | 某小组研究人员成功制备出了四氧化铱正离子(IrO4+),其球棍模型为 ,由此可判断其中铱元素显+9价 ,由此可判断其中铱元素显+9价 | |
| D. | 门捷列夫根据元素性质随元素的相对原子质量递增而显现元素周期性变化的规律排出了第一张元素周期表 |
N2(g)+3H2(g)═2NH3(g)△H=-92.6kJ•mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系 能量的变化 | ||
| N2 | H2 | NH3 | |||
| ① | 1 | 3 | 0 | 2分钟 | 放热 46.3 kJ |
| ② | 0.4 | 1.2 | 1.2 | / | Q(Q>0) |
| A. | 达平衡时,两个容器中NH3的物质的量浓度相等 | |
| B. | 容器①中反应从开始到刚达平衡时用NH3表示的反应速率为v(NH3)=$\frac{1}{30}$mol•L-1•s-1 | |
| C. | 若容器①体积为0.3 L,则达平衡时放出的热量大于46.3kJ | |
| D. | 容器②中反应达到平衡时吸收的热量为Q |
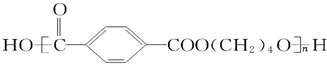 其单体是
其单体是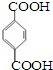 、HO-CH2CH2CH2CH2-OH.
、HO-CH2CH2CH2CH2-OH.