题目内容
下列溶液中各微粒的浓度关系正确的是( )
| A、室温下,pH=7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+) |
| B、将10mL 0.1mol?L-1 Na2CO3溶液逐滴滴加到10mL 0.1mol?L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) |
| C、等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+) |
| D、0.2mol?L-1的某一元弱酸HA溶液和0.1mol?L-1 NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)=2c(H+)+c(HA) |
考点:离子浓度大小的比较,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.室温下,pH=7的溶液中存在c(OH-)=c(H+),再结合电荷守恒判断;
B.二者先反应生成氯化钠、水和二氧化碳,当盐酸反应完全后,再滴加碳酸钠溶液,碳酸钠不反应,溶液中的溶质是氯化钠和碳酸钠;
C.等pH的氨水、KOH溶液、Ba(OH)2溶液中氢氧根离子浓度相等,再结合电荷守恒判断;
D.溶液中的溶质是等物质的量浓度的NaA和HA,溶液呈存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
B.二者先反应生成氯化钠、水和二氧化碳,当盐酸反应完全后,再滴加碳酸钠溶液,碳酸钠不反应,溶液中的溶质是氯化钠和碳酸钠;
C.等pH的氨水、KOH溶液、Ba(OH)2溶液中氢氧根离子浓度相等,再结合电荷守恒判断;
D.溶液中的溶质是等物质的量浓度的NaA和HA,溶液呈存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
解答:
解:A.室温下,pH=7的溶液中存在c(OH-)=c(H+),再结合电荷守恒得c(CH3COO-)=c(Na+),故A错误;
B.二者先反应生成氯化钠、水和二氧化碳,当盐酸反应完全后,再滴加碳酸钠溶液,碳酸钠不反应,溶液中的溶质是氯化钠和碳酸钠,且碳酸钠和氯化钠的物质的量相等,结合物料守恒得c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-),故B错误;
C.等pH的氨水、KOH溶液、Ba(OH)2溶液中氢氧根离子浓度相等,根据离子积常数知,氢离子浓度相等,再结合电荷守恒得c(NH4+)=c(K+)=2c(Ba2+),故C错误;
D.溶液中的溶质是等物质的量浓度的NaA和HA,溶液呈存在电荷守恒和物料守恒,根据电荷守恒c(OH-)+c(A-)=c(H+)+c(Na+),根据物料守恒得c(A-)+c(HA)=2c(Na+),所以得2c(OH-)+c(A-)=2c(H+)+c(HA),故D正确;
故选D.
B.二者先反应生成氯化钠、水和二氧化碳,当盐酸反应完全后,再滴加碳酸钠溶液,碳酸钠不反应,溶液中的溶质是氯化钠和碳酸钠,且碳酸钠和氯化钠的物质的量相等,结合物料守恒得c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-),故B错误;
C.等pH的氨水、KOH溶液、Ba(OH)2溶液中氢氧根离子浓度相等,根据离子积常数知,氢离子浓度相等,再结合电荷守恒得c(NH4+)=c(K+)=2c(Ba2+),故C错误;
D.溶液中的溶质是等物质的量浓度的NaA和HA,溶液呈存在电荷守恒和物料守恒,根据电荷守恒c(OH-)+c(A-)=c(H+)+c(Na+),根据物料守恒得c(A-)+c(HA)=2c(Na+),所以得2c(OH-)+c(A-)=2c(H+)+c(HA),故D正确;
故选D.
点评:本题考查了离子浓度大小比较,明确溶液中的溶质及溶液性质再结合守恒思想分析解答,易错选项是B,注意碳酸钠溶液滴入盐酸中和盐酸滴入碳酸钠溶液中的区别,为易错点.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、长期使用阿司匹林会出现水杨酸中毒表现,应立即停药,静脉注射碳酸氢钠溶液 |
| B、红宝石、水晶、钻石的主要成分都是硅酸盐 |
| C、高温条件下可杀死H7N9型禽流感病毒,属于蛋白质的变性 |
| D、石油裂解、煤的气化、海水制镁都包含化学变化 |
下列关于化学与生产、生活的认识正确的是( )
| A、CO2、CH4、N2等均是造成温室效应的气体 |
| B、酸雨是pH小于7的雨水 |
| C、CO2、NO2或SO2都会导致酸雨的形成 |
| D、合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
下列混合溶液中,各离子浓度的大小关系不正确的是( )
| A、物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| B、0.1mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| C、物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合,离子浓度的大小顺序是:c (Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| D、NH4Cl溶液中:c(H+)=c(NH3?H2O)+c(OH-) |
用pH试纸测定某无色溶液的pH时,规范的操作是( )
| A、将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较 |
| B、将溶液倒在pH试纸上,跟标准比色卡比较 |
| C、将pH试纸放在干燥的表面皿上,用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸中央,跟标准比色卡比较 |
| D、在试管内放入少量溶液煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较 |
在物质分类中常存在包含关系如图B包含A,下列关系中前者包含后者.其中错误的是( )
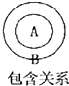

| A、有机物 烃 |
| B、烃 脂肪烃 |
| C、脂肪烃 烯烃 |
| D、烯烃 氯乙烯 |
根据相似相溶规则和实际经验,下列叙述不正确的是( )
| A、白磷(P4)易溶于CS2,但难溶于水 |
| B、NaCl易溶于水,也易溶于CCl4 |
| C、碘易溶于苯,微溶于水 |
| D、卤化氢易溶于水,难溶于CCl4 |
短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5.X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物.下列说法错误的是( )
| A、X、Y、Z都是非金属元素 |
| B、X、Y的最高价氧化物所对应的水化物酸性X>Y |
| C、X、Y、Z的电负性大小顺序是Z>X>Y |
| D、由X、Y、Z三种元素可形成多种共价化合物 |
实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )
A、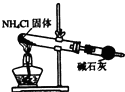 氨气发生装置 |
B、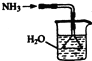 氨气吸收装置 |
C、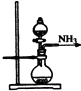 氨气发生装置 |
D、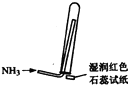 氨气收集、检验装置 |