题目内容
用不含Fe3+ 的FeSO4 溶液与用不含O2的蒸馏水配制的Na溶液反应制备氢氧化亚铁。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入____________________
(2)除去蒸馏水中溶解的氧气常采用的方法是________________
(3)生成白色Fe(OH)2沉淀的操作使用长滴管吸取不含O2 的NaOH溶液,插入FeSO4溶液液面以下,再挤出NaOH溶液。这样操作的理由是___________________________________________________
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入____________________
(2)除去蒸馏水中溶解的氧气常采用的方法是________________
(3)生成白色Fe(OH)2沉淀的操作使用长滴管吸取不含O2 的NaOH溶液,插入FeSO4溶液液面以下,再挤出NaOH溶液。这样操作的理由是___________________________________________________
稀硫酸,加热煮沸,氢氧化亚铁已被空气中的氧气氧化成氢氧化铁
分析:(1)根据FeSO4易被空气中的氧气氧化和易水解的特点分析;
(2)根据气体的溶解度随温度的升高而减小分析;
(3)根据氢氧化亚铁极易被空气中的氧气氧化成氢氧化铁分析.
解答:解:(1)根据FeSO4具有易被氧化和易水解的特点,在配制其溶液时还需加入稀H2SO4防止发生水解反应,同时加入铁屑防止硫酸亚铁被氧化.
故答案为:稀H2SO4;铁屑;
(2)蒸馏水中若溶有O2,则会加速Fe(OH)2氧化,由于氧气的溶解度随温度的升高而减小,因此可采用加热煮沸的方法除去.
故答案为:加热煮沸;
(3)为避免生成的Fe(OH)2沉淀接触O2,可用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液方可达到目的.
故答案为:氢氧化亚铁已被空气中的氧气氧化成氢氧化铁.
点评:实验方案的设计与评价是化学考查的热点题目之一,难度较大,要加强练习,透彻理解教材上的实验原理,掌握方案设计的基本思路和方法,注重培养对比分析的思维能力,问题便会迎刃而解.

练习册系列答案
相关题目
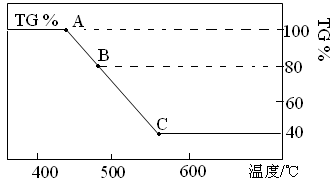
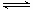 Fe(s) + CO2(g)的平衡常数K=1/3,则反应达平衡时FeO的转化率为 。
Fe(s) + CO2(g)的平衡常数K=1/3,则反应达平衡时FeO的转化率为 。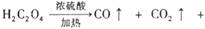
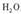 。下列装置中,可用作上述反应制取气体的是(填编号)。
。下列装置中,可用作上述反应制取气体的是(填编号)。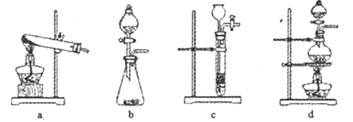
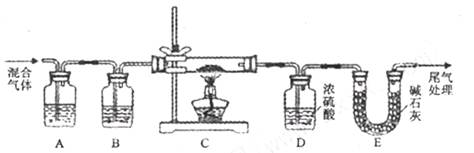
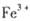 外还可能含有
外还可能含有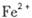 。若要确认其中的
。若要确认其中的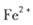 .应选用 ________________(填编号)。
.应选用 ________________(填编号)。