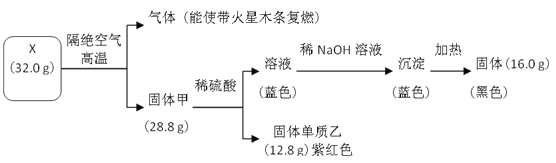
题目内容
【题目】过硫酸钾(![]() )具有强氧化性(常被还原为硫酸钾),80℃以上易发生分解.实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80℃以上易发生分解.实验室模拟工业合成过硫酸钾的流程如下:
(1)硫酸铵和硫酸配制成电解液,以铂作电极进行电解,生成过硫酸铵溶液.写出电解时发生反应的离子方程式________________________.
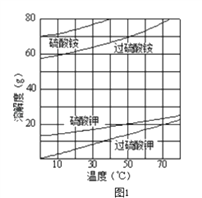
(2)已知相关物质的溶解度曲线如图1所示.在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中,__________________________,干燥.
(3)样品中过硫酸钾的含量可用碘量法进行测定.实验步骤如下:
步骤1:称取过硫酸钾样品0.3000g于碘量瓶中,加入30mL水溶解.
步骤2:向溶液中加入4.000g KI固体(略过量),摇匀,在暗处放置30min.
步骤3:在碘量瓶中加入适量醋酸溶液酸化,以淀粉溶液作指示剂,用0.1000molL﹣1 Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液21.00mL.(已知反应:I2+2S2O32﹣=2I﹣+S4O62﹣)
①若步骤2中未将碘量瓶“在暗处放置30min”,立即进行步骤3,则测定的结果可能_______(选填“偏大”、“偏小”、“无影响”);上述步骤3中滴定终点的现象是_________.
②根据上述步骤可计算出该样品中过硫酸钾的质量分数为_______.
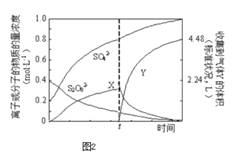
(4)将0.40mol过硫酸钾与0.20mol硫酸配制成1L溶液,在80℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如图2所示(H+浓度未画出).图中物质X的化学式为________。
【答案】 2SO42﹣+2H+![]() S2O82﹣+H2↑ 在不超过80℃的条件下加热浓缩,冷却结晶,过滤,用冷水洗涤 偏小 最后一滴滴入后溶液由蓝色变为无色,且30 s不变色 94.50%(或0.9450) H2O2
S2O82﹣+H2↑ 在不超过80℃的条件下加热浓缩,冷却结晶,过滤,用冷水洗涤 偏小 最后一滴滴入后溶液由蓝色变为无色,且30 s不变色 94.50%(或0.9450) H2O2
【解析】(1)硫酸铵和硫酸配制成电解液,以铂作电极进行电解,生成过硫酸铵溶液,说明电解时阳极上SO42-被氧化生成S2O82-,溶液呈酸性,阴极发生还原反应生成氢气,则电解方程式为2SO42﹣+2H+![]() S2O82﹣+H2↑;(2)由图1可知,过硫酸钾溶解度较小,可用溶解、结晶、过滤、洗涤的方法提纯,注意加热温度不能超过80℃,故答案为:在不超过80℃的条件下加热浓缩,冷却结晶,过滤,用冷水洗涤;(3)①若步骤2中未将碘量瓶“在暗处放置30min”,则KI为充分与过硫酸钾发生反应,溶液中生成的碘较少,则用Na2S2O3标准溶液滴定时测定结果偏小;滴定终点,溶液由蓝色变为无色,故答案为:偏小; 最后一滴滴入后溶液由蓝色变为无色,且30 s不变色;②由信息过硫酸钾(
S2O82﹣+H2↑;(2)由图1可知,过硫酸钾溶解度较小,可用溶解、结晶、过滤、洗涤的方法提纯,注意加热温度不能超过80℃,故答案为:在不超过80℃的条件下加热浓缩,冷却结晶,过滤,用冷水洗涤;(3)①若步骤2中未将碘量瓶“在暗处放置30min”,则KI为充分与过硫酸钾发生反应,溶液中生成的碘较少,则用Na2S2O3标准溶液滴定时测定结果偏小;滴定终点,溶液由蓝色变为无色,故答案为:偏小; 最后一滴滴入后溶液由蓝色变为无色,且30 s不变色;②由信息过硫酸钾(![]() )具有强氧化性(常被还原为硫酸钾),可知过硫酸钾与碘化钾反应反应的离子方程式应为S2O82-+2I-=2SO42-+I2,加入Na2S2O3标准溶液发生I2+2S2O32-=2I-+S4O62-,可得关系式S2O82-~2S2O32-,n(Na2S2O3)=0.1000mol/L×0.021L=2.1×10-3mol,则由S2O82-~2S2O32-,可知n(K2S2O8)=1.05×10-3mol,m(K2S2O8)=1.05×10-3mol×270g/mol=0.2835g,则ω(K2S2O8)=
)具有强氧化性(常被还原为硫酸钾),可知过硫酸钾与碘化钾反应反应的离子方程式应为S2O82-+2I-=2SO42-+I2,加入Na2S2O3标准溶液发生I2+2S2O32-=2I-+S4O62-,可得关系式S2O82-~2S2O32-,n(Na2S2O3)=0.1000mol/L×0.021L=2.1×10-3mol,则由S2O82-~2S2O32-,可知n(K2S2O8)=1.05×10-3mol,m(K2S2O8)=1.05×10-3mol×270g/mol=0.2835g,则ω(K2S2O8)=![]() ×100%=94.50%(或0.9450);③为减少实验误差,可重复操作1~2次,故答案为:重复上述实验步骤1~2次;(4)过硫酸钾80℃以上易发生分解生成X,X在FeCl3溶液作用下生成气体,该气体应为氧气,X应为H2O2。
×100%=94.50%(或0.9450);③为减少实验误差,可重复操作1~2次,故答案为:重复上述实验步骤1~2次;(4)过硫酸钾80℃以上易发生分解生成X,X在FeCl3溶液作用下生成气体,该气体应为氧气,X应为H2O2。

【题目】由CO和H2S反应可制得羰基硫(COS)。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g),数据如下表所示:
COS(g)+H2(g),数据如下表所示:
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
下列说法正确的是( )
A. 上述反应是吸热反应
B. 实验1达平衡时,CO的转化率为70%
C. 实验2达平衡时,a<7.0
D. 实验3达平平衡后,再充入1.0molH2,平衡逆向移动,平衡常数值增大