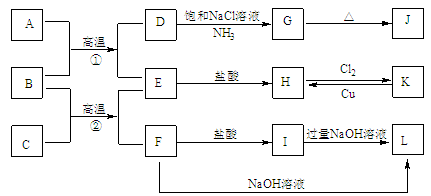
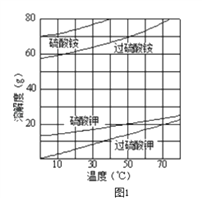
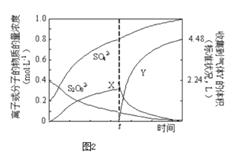
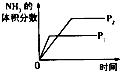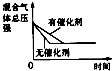题目内容
【题目】由CO和H2S反应可制得羰基硫(COS)。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g),数据如下表所示:
COS(g)+H2(g),数据如下表所示:
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
下列说法正确的是( )
A. 上述反应是吸热反应
B. 实验1达平衡时,CO的转化率为70%
C. 实验2达平衡时,a<7.0
D. 实验3达平平衡后,再充入1.0molH2,平衡逆向移动,平衡常数值增大
【答案】C
【解析】A、实验1中,开始通入20.0mol的CO和20.0molH2S,建立的平衡,与开始通入10.0mol的CO和10.0molH2S,建立的平衡互为等效平衡,通入20.0mol的CO和20.0molH2S,达到平衡, CO物质的量为(20-20×3/10)mol=14mol,温度由150℃升高到400℃,CO的物质的量由14mol→16mol,升高温度,平衡向逆反应反应方向移动,即正反应是放热反应,故A错误;B、实验1中消耗CO的物质的量为(10-7.0)mol=3mol,即CO的转化率为3/10×100%=30%,故B错误;
C、 CO(g)+H2S(g) ![]() COS(g)+H2(g)
COS(g)+H2(g)
起始:10 10 0 0
变化:3 3 3 3
平衡:7 7 3 3 ,此温度下,K=![]() ,实验2中浓度商Qc=
,实验2中浓度商Qc=![]() <K,说明反应正向移动,即a<7.0,故C正确;D、平衡常数只受温度的影响,因此再充入1.0molH2,平衡逆向移动,但化学平衡常数不变,故D错误。
<K,说明反应正向移动,即a<7.0,故C正确;D、平衡常数只受温度的影响,因此再充入1.0molH2,平衡逆向移动,但化学平衡常数不变,故D错误。

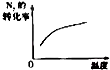
【题目】对于可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A.A
B.B
C.C
D.D