题目内容
12.实验室里需要用450mL 0.1mol•L-1的NaOH溶液.其涉及的实验试剂及仪器有:NaOH固体、蒸馏水、烧杯、天平、药匙、胶头滴管.经过的实验步骤如下:①计算②称量③溶解④转移⑤洗涤⑥定容⑦摇匀⑧装瓶(1)实验中用所需NaOH固体质量为2.0g.
(2)实验步骤中没有写出的步骤名称是⑤洗涤.
(3)本实验实验还缺少的仪器有:500mL容量瓶、玻璃棒.
(4)下列情况对所配制的NaOH浓度影响偏大的是③⑤⑥,影响偏小的是①②,无影响的是④.
①未使用小烧杯进行称量
②称量时间过长
③容量瓶中曾经配制过同浓度NaOH溶液,未经清洗就使用
④容量瓶清洗后残留有少量蒸馏水
⑤NaOH溶解后立即转移到容量瓶中
⑥定容时俯视溶液的凹液面
(5)用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是重新配制.
分析 (1)依据m=CVM计算需要溶质的质量;
(2)配制一定物质的量浓度溶液的一般步骤为:①计算②称量③溶解④转移⑤洗涤⑥定容⑦摇匀⑧装瓶,据此解答;
(3)依据配制一定物质的量浓度溶液的一般步骤选择合适的仪器;
(4)分析操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(5)实验操作过程中一旦出现错误,应宣告实验失败,洗净容量瓶后重新配制.
解答 解:(1)450mL 0.1mol•L-1的NaOH溶液,应选择500mL容量瓶,实际配制500mL溶液,需要溶质的质量=0.1mol•L-1×0.5L×40g/mol=2.0g;
故答案为:2.0;
(2)配制一定物质的量浓度溶液的一般步骤为::①计算②称量③溶解④转移⑤洗涤⑥定容⑦摇匀⑧装瓶;
故答案为:洗涤;
(3)配制一定物质的量浓度溶液的一般步骤为:①计算②称量③溶解④转移⑤洗涤⑥定容⑦摇匀⑧装瓶,用到的仪器:烧杯、天平、药匙、胶头滴管、
500mL容量瓶、玻璃棒;还缺少的是:500mL容量瓶、玻璃棒;
故答案为:500mL容量瓶、玻璃棒;
(4)①未使用小烧杯进行称量,导致秤取的氢氧化钠物质的量偏小,溶液的浓度偏低;
②称量时间过长,导致秤取的氢氧化钠物质的量偏小,溶液的浓度偏低;
③容量瓶中曾经配制过同浓度NaOH溶液,未经清洗就使用,导致溶质的物质的量偏大,溶液浓度偏高;
④容量瓶清洗后残留有少量蒸馏水,对溶质的物质的量和溶液的体积都不产生影响,溶液浓度不变;
⑤NaOH溶解后立即转移到容量瓶中,冷却后,溶液体积减小,溶液浓度偏高;
⑥定容时俯视溶液的凹液面,导致溶液体积偏小,溶液浓度偏高;
所以所配制的NaOH浓度影响偏大的是:③⑤⑥;影响偏小的是①②;无影响的是④;
故答案为:③⑤⑥;①②;④;
(5)用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,应宣告实验失败,洗净容量瓶后重新配制,故答案为:重新配制.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和步骤是解题关键,注意误差分析方法.

| A. | BaCl2溶液和NaOH溶液 | B. | 稀H2S04和Ba(OH)2溶液 | ||
| C. | AgNO3溶液和NaCl溶液 | D. | H20和CCl4 |
| A. | 26.8g | B. | 28.7g | C. | 29.1g | D. | 29.5g |
| A. | Fe2O3与FeO的物质的量之比为1:6 | |
| B. | 硝酸的物质的量浓度为3.0 mol/L | |
| C. | 产生的NO在标准状况下的体积为4.48 L | |
| D. | Fe2O3,FeO与硝酸反应后剩余HNO3为0.2 mol |
| A. | 2 Fe3++2 I-═2 Fe2++I2 | B. | Cl2+FeI2═FeCl2+I2 | ||
| C. | Co2O3+6 HCl═2 CoCl2+Cl2+3 H2O | D. | 3 Cl2+6 FeI2═2 FeCl3+4 FeI3 |
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铝溶液中加入过量的氨水Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 铝片投入硝酸汞溶液中:Al+Hg2+═Al3++Hg | |
| D. | 金属钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ |
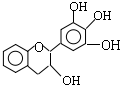 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是 ( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是 ( )| A. | 原子中所有的原子共面 | |
| B. | molEGC与4molNaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,难发生加成反应 | |
| D. | 遇FeCl3溶液发生显色反应 |
| 验方法 | 沉淀法 | 显色法 | 气体法 |
| 判断的依据 | 反应中有沉淀产生或溶解 | 反应中有颜色变化 | 反应中有气体产生 |
| A. | CO32---气体法 | B. | SO42---沉淀法 | C. | H+--显色法 | D. | Cl---气体法 |
 已知热化学方程式H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,
已知热化学方程式H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,