题目内容
3.镁、铁混合物13.4g溶解在足量的稀硝酸中,完全反应得到还原产物只有6.72L(标况下)NO,则向反应后的溶液中加人足量的NaOH溶液,可生成的沉淀质量为( )| A. | 26.8g | B. | 28.7g | C. | 29.1g | D. | 29.5g |
分析 m(沉淀)=m(混合物)+m(OH-),反应中存在:Mg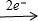 Mg2+
Mg2+ Mg(OH)2,Fe
Mg(OH)2,Fe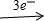 Fe3+→Fe(OH)3,根据关系式可得出n(e-)=n(OH-),以此计算沉淀的质量.
Fe3+→Fe(OH)3,根据关系式可得出n(e-)=n(OH-),以此计算沉淀的质量.
解答 解:n(NO)=$\frac{6.72L}{22.4L/mol}$=0.3mol,生成0.3mol NO,转移的电子的物质的量为:n(e-)=0.3mol×(5-2)=0.9mol,
反应中存在:Mg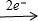 Mg2+
Mg2+ Mg(OH)2,Fe
Mg(OH)2,Fe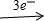 Fe3+→Fe(OH)3,
Fe3+→Fe(OH)3,
则:n(e-)=n(OH-),
所以m(沉淀)=m(混合物)+m(OH-)=13.4g+0.9mol×17g/mol=28.7g,
故选B.
点评 本题考查混合物反应的计算,题目难度中等,解答本题注意从电子守恒和质量守恒的角度分析,找出电子与氢氧根离子的物质的量的关系是解答本题的关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体--黑磷,其转化过程如下:白磷$\stackrel{12159MPa,473K,隔绝空气}{→}$黑磷,黑磷性质稳定,结构与石墨相似.下列叙述正确的是( )
| A. | 黑磷与白磷互为同分异构体 | B. | 黑磷能导电 | ||
| C. | 白磷转化为黑磷是物理变化 | D. | 黑磷能在空气中自燃 |
14.要从硝酸钾和食盐(少量)的混合物中,分离出较纯净的硝酸钾,应把它们( )
| A. | 溶解、过滤 | B. | 制成饱和溶液,降温后再过滤 | ||
| C. | 加热、冷却后结晶 | D. | 溶解、过滤后结晶 |
11.100mL 0.03mol•L-1 Na2SO4溶液和50mL 0.02mol•L-1 Al2(SO4)3溶液混合,下列说法中正确的是(不考虑混合后溶液体积的变化)( )
| A. | 混合液中c(SO${\;}_{4}^{2-}$)为0.04 mol•L-1 | |
| B. | 原Al2(SO4)3溶液中c(Al3+)与100 mL 0.02 mol•L-1 Al(NO3)3中c(Al3+)相等 | |
| C. | 混合后的溶液中含有0.003 mol Na+ | |
| D. | 混合后溶液中c(Na+)为0.02 mol•L-1 |
8.恒温条件下,对于在一定体积的容器中进行的可逆反应C(s)+CO2(g)?2CO(g),下列描述不能说明该反应达到平衡状态的是( )
| A. | 体系压强不变 | B. | 气体平均相对分子质量不变 | ||
| C. | 气体密度不变 | D. | c(CO2):c(CO)=1:2 |
15.下列解释实验现象的反应方程式正确的是( )
| A. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2═Na2O2 | |
| B. | 电解饱和食盐水:2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | |
| C. | Na2O2在潮湿空气中放置一段时间,变成白色黏稠物:2Na2O2+2CO2═2Na2CO3+O2 | |
| D. | 向NaHCO3溶液中加入少量的澄清石灰水,出现白色沉淀:2HCO${\;}_{3}^{-}$+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
13.下列各组混合物的分离或提纯方法不正确的是( )
| A. | 用过滤的方法分离CaCO3和CaCl2溶液的混合物 | |
| B. | 用结晶法提纯NaCl和KNO3混合物中的KNO3 | |
| C. | 用蒸馏法分离乙醇和水的混合物 | |
| D. | 用加热法分离碘和氯化铵的混合物(提示:碘易升华,氯化铵受热易分解.冷却后它们都又重新生成固体) |