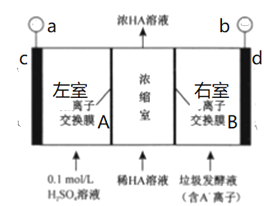
题目内容
【题目】煅烧黄铁矿(主要成分为FeS2)所得的矿渣中含Fe2O3、SiO2、Al2O3、MgO等.用该矿渣可制备铁红(Fe2O3).完成下列填空:
(1)煅烧黄铁矿的化学方程式____,反应过程中被氧化的元素____.
(2)矿渣中属于两性氧化物的是___,写出Fe2O3与稀硫酸反应的离子方程式__.
(3)Al(OH)3的碱性比Mg(OH)2的碱性___(选填“强”或“弱”);铝原子最外层电子排布式为____.
(4)SiO2的熔点___ Fe2O3的熔点(填“大于”或“小于”),原因是__.
(5)已知矿渣质量为w kg,若铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来矿渣中铁元素质量分数为______(用表达式表示).
【答案】4FeS2+11O2![]() 2Fe2O3+8SO2 Fe、S Al2O3 Fe2O3+6H+=2Fe3++3H2O 弱 3s23p1 大于 原子晶体熔点高于离子晶体,二氧化硅为原子晶体,氧化铁为离子晶体
2Fe2O3+8SO2 Fe、S Al2O3 Fe2O3+6H+=2Fe3++3H2O 弱 3s23p1 大于 原子晶体熔点高于离子晶体,二氧化硅为原子晶体,氧化铁为离子晶体 ![]()
【解析】
(1)煅烧黄铁矿得到的产物是氧化铁和二氧化硫,化合价升高元素在反应中被氧化;
(2)既能和强酸反应又能和强碱反应得到盐和水的氧化物,称为两性氧化物,Fe2O3与稀硫酸反应生成硫酸铁和水;
(3)同主族元素从左到右最高价氧化物对应水化物的碱性逐渐减弱,根据原子核外电子的排布知识来回答;
(4)原子晶体熔点高于离子晶体;
(5)根据铁元素守恒来计算即可。
(1)煅烧黄铁矿得到的产物是氧化铁和二氧化硫,即:4FeS2+11O2![]() 2Fe2O3+8SO2,化合价升高的Fe、S元素在反应中被氧化;
2Fe2O3+8SO2,化合价升高的Fe、S元素在反应中被氧化;
(2)氧化铝是既能和强酸反应又能和强碱反应得到盐和水的氧化物,属于两性氧化物,Fe2O3与稀硫酸反应的离子方程式Fe2O3+6H+=2Fe3++3H2O;
(3)同主族元素从左到右最高价氧化物对应水化物的碱性逐渐减弱,Al(OH)3的碱性比Mg(OH)2的碱性弱,铝原子最外层有3个电子,电子排布式为:3s23p1;
(4)二氧化硅为原子晶体,氧化铁为离子晶体,原子晶体熔点高于离子晶体,所以SiO2的熔点大于Fe2O3的熔点;
(5)铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为mkg,铁红中含有铁元素的质量是![]() =
=![]() ,原来矿渣中铁元素质量是
,原来矿渣中铁元素质量是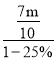 =
=![]() ,则原来矿渣中铁元素质量分数为
,则原来矿渣中铁元素质量分数为![]() 。
。

【题目】由下列实验及现象不能推出相应结论的是
选项 | 实验 | 现象 | 结论 |
A | 向两支盛有2 mL相同浓度银氨溶液的试管中滴加2滴相同浓度的NaCl和NaI溶液 | 一支产生黄色沉淀,另一只无明显现象 | Ksp(AgI)<Ksp(AgCl) |
B | 向10 mL 0.1 mol/L AgNO3溶液中滴加2滴0.01 mol/L NaBr溶液,再滴加2滴0.01 mol/ LNa2S溶液 | 先产生浅黄色沉淀,然后出现黑色沉淀 | Ksp(AgBr)>Ksp(Ag2S) |
C | 向盛有2 mL 0.1 mol/L MgCl2溶液的试管中先滴加2滴2 mol/L NaOH溶液,再滴加2滴0.01 mol/L CuCl2溶液 | 先产生白色沉淀,然后白色沉淀变蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
D | 将H2S通人浓度均为0.01 mol/L的ZnSO4和CuSO4混合液中 | 先产生黑色的CuS沉淀 | Ksp(ZnS)>Ksp(CuS) |
A.AB.BC.CD.D