题目内容
【化学——选修3:物质结构与性质】(15分)
用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:

(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、
②的化学方程式是 、 。
(2)基态铜原子的核外电子排布式为 ,硫、氧元素相比,第一电离能较大的是 。
(3)反应①和②生成的气体分子的中心原子的杂化类型是 ,分子的空间构型是 。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因 ;在该晶体中存在化学键的种类有 。
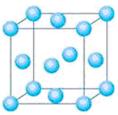
(5)Cu2O的晶胞结构如图所示,该晶胞的边长为a cm,则Cu2O的密
度为 g·cm-3(用NA表示阿伏加德罗常数的数值)。
用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:

(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、
②的化学方程式是 、 。
(2)基态铜原子的核外电子排布式为 ,硫、氧元素相比,第一电离能较大的是 。
(3)反应①和②生成的气体分子的中心原子的杂化类型是 ,分子的空间构型是 。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因 ;在该晶体中存在化学键的种类有 。
(5)Cu2O的晶胞结构如图所示,该晶胞的边长为a cm,则Cu2O的密
度为 g·cm-3(用NA表示阿伏加德罗常数的数值)。

(15分)(1)2Cu2S+3O2 2Cu2O+2SO2 2Cu2O+Cu2S
2Cu2O+2SO2 2Cu2O+Cu2S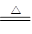 6Cu+SO2↑(各2分,共4分)
6Cu+SO2↑(各2分,共4分)
(2)1s22s22p63s23d104s1或[Ar]3d104s1 ;O (各1分,共2分)
(3)sp2;V型 (各1分,共2分)
(4)乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;离子键、配位键、共价键(错1个扣1分,错2个0分) (各2分,共4分)
(5) (3分)
(3分)
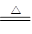 2Cu2O+2SO2 2Cu2O+Cu2S
2Cu2O+2SO2 2Cu2O+Cu2S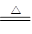 6Cu+SO2↑(各2分,共4分)
6Cu+SO2↑(各2分,共4分)(2)1s22s22p63s23d104s1或[Ar]3d104s1 ;O (各1分,共2分)
(3)sp2;V型 (各1分,共2分)
(4)乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;离子键、配位键、共价键(错1个扣1分,错2个0分) (各2分,共4分)
(5)
 (3分)
(3分)(1)反应①、②中均生成相同的气体分子,该气体具有漂白性,由质量守恒可知为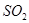 气体,则反应①、②的化学方程式为:2Cu2S+3O2
气体,则反应①、②的化学方程式为:2Cu2S+3O2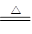 2Cu2O+2SO2;
2Cu2O+2SO2;
2Cu2O+Cu2S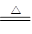 6Cu+SO2↑;
6Cu+SO2↑;
(2)根据构造原理可知,基态铜原子的核外电子排布式为1s22s22p63s23d104s1或[Ar]3d104s1 ;硫、氧元素相比,第一电离能较大的是O;
(3)反应①和②生成的气体分子的中心原子的杂化类型是sp2;分子的空间构型为V型;
(4)加入乙醇后析出晶体的原因乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;在该晶体中存在化学键的种类有离子键、配位键、共价键;
(5)由图可知Cu2O的密度为 ;
;
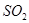 气体,则反应①、②的化学方程式为:2Cu2S+3O2
气体,则反应①、②的化学方程式为:2Cu2S+3O2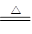 2Cu2O+2SO2;
2Cu2O+2SO2;2Cu2O+Cu2S
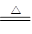 6Cu+SO2↑;
6Cu+SO2↑;(2)根据构造原理可知,基态铜原子的核外电子排布式为1s22s22p63s23d104s1或[Ar]3d104s1 ;硫、氧元素相比,第一电离能较大的是O;
(3)反应①和②生成的气体分子的中心原子的杂化类型是sp2;分子的空间构型为V型;
(4)加入乙醇后析出晶体的原因乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;在该晶体中存在化学键的种类有离子键、配位键、共价键;
(5)由图可知Cu2O的密度为
 ;
;
练习册系列答案
相关题目