题目内容
(13分)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素,试回答下列问题:
(1)请写出G的淡黄色化合物与二氧化碳反应的方程式 。
(2)D的气态氢化物的VSEPR模型为 _ ,其中心原子的杂化类型为_______ 。
(3)G、H和I的第一电离能数值由大到小的顺序为: (用元素符号作答)。
(4)由A、C、D形成的1mol ACD分子中,含有 个σ键, 个π键。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的
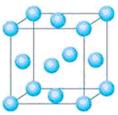
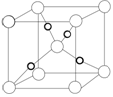
元素还有_______________(填元素符号),其中一种金属的晶胞结构如右
图所示,该晶胞中含有金属原子的数目为 。
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2
是__________(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有____________(填分子式)。
| A | | R | |||||||||||||||
| B | | | | | | | | | | | | C | D | E | F | T | |
| G | H | I | J | | K | L | | ||||||||||
| | | | | | M | | N | | | | | | | | | | |
(2)D的气态氢化物的VSEPR模型为 _ ,其中心原子的杂化类型为_______ 。
(3)G、H和I的第一电离能数值由大到小的顺序为: (用元素符号作答)。
(4)由A、C、D形成的1mol ACD分子中,含有 个σ键, 个π键。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的
元素还有_______________(填元素符号),其中一种金属的晶胞结构如右
图所示,该晶胞中含有金属原子的数目为 。

②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2
是__________(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有____________(填分子式)。
(13分)(1)2Na2O2+2CO2=2Na2CO3+O2 (2)四面体 sp3
(3)Mg>Al>Na (4) 2NA 2NA
(5))①K、Cu 4 ②非极性 ③ C2H4、CH2O
(3)Mg>Al>Na (4) 2NA 2NA
(5))①K、Cu 4 ②非极性 ③ C2H4、CH2O
(1)相关方程式:2Na2O2+2CO2=2Na2CO3+O2。
(2)氨分子中含有3个δ,1个孤电子对,价层电子对4,SEPR模型为四面体型,中心原子N采用的是 sp3 杂化。
(3)同周期,第一电离能逐渐增大,同时镁原子核外电子排布:1S22S22P6,处于全空状态,稳定,第一电离能较大,所以第一电离能从大到小:Mg>Al>Na。
(4)HNO分子中含有含有2NA个σ键,2NA个π键。
(5)①Cr原子价电子排布:3d54S1,同周期最外层电子有1个的原子有:K、Cu 。②相似相溶,MO2Cl2 为非极性分子;③平面构型的有C2H4、CH2O。
点评:考察核外电子排布,中心原子的杂化类型等。
(2)氨分子中含有3个δ,1个孤电子对,价层电子对4,SEPR模型为四面体型,中心原子N采用的是 sp3 杂化。
(3)同周期,第一电离能逐渐增大,同时镁原子核外电子排布:1S22S22P6,处于全空状态,稳定,第一电离能较大,所以第一电离能从大到小:Mg>Al>Na。
(4)HNO分子中含有含有2NA个σ键,2NA个π键。
(5)①Cr原子价电子排布:3d54S1,同周期最外层电子有1个的原子有:K、Cu 。②相似相溶,MO2Cl2 为非极性分子;③平面构型的有C2H4、CH2O。
点评:考察核外电子排布,中心原子的杂化类型等。

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
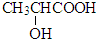 )存在对映异构体,因为其分子中含有一个手性碳原子
)存在对映异构体,因为其分子中含有一个手性碳原子