题目内容
8.下列说法正确的是( )| A. | 投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO42-、NO3- | |
| B. | 可用稀硝酸除去试管内壁上的银镜 | |
| C. | 1.0 mol•L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO42- | |
| D. | 硫化铜溶于硝酸的离子方程式为CuS+2H+═H2S↑+Cu2+ |
分析 A.投入铁片产生H2的溶液,为非氧化性酸;
B.Ag与稀硝酸反应;
C.离子之间发生氧化还原反应;
D.硫化铜溶于硝酸,发生氧化还原反应.
解答 解:A.投入铁片产生H2的溶液,为非氧化性酸,酸溶液中Fe、H+、NO3-反应不生成氢气,故A错误;
B.Ag与稀硝酸反应,则可用稀硝酸除去试管内壁上的银镜,故B正确;
C.H+、Fe2+、NO3-发生氧化还原反应,不能大量共存,故C错误;
D.硫化铜溶于硝酸,发生氧化还原反应,硫化铜溶于硝酸的离子方程式为3CuS+8NO3-+8H+═8NO↑+4H2O+3SO42-+3Cu2+,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应及分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
18.下列反应中属于氧化还原反应的是( )
| A. | CO2+2NaOH═Na2CO3+H2O | B. | CuO+2HCl═CuCl2+H2O | ||
| C. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | D. | CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO |
19.下列装置或操作能达到实验目的是( )
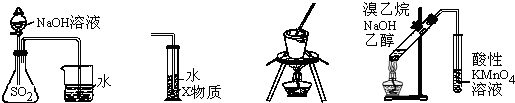

| A. | 装置①可用于证明SO2与NaOH溶液发生了反应 | |
| B. | 装置②中X为CCl4,可用于吸收氨气或氯化氢 | |
| C. | 装置③可用于实验室从食盐水中提取氯化钠 | |
| D. | 装置④可用于证明溴乙烷与NaOH醇溶液共热生成乙烯 |
16.标准状况下,有①6.72L甲烷,②3.01×1023个HCl分子,③34gH2S气,④0.2mol氨气,则下列四种气体关系表示正确的是( )
| A. | 体积④<①<②<③ | B. | 密度①<③<④<② | C. | 质量④<①<③<② | D. | 氢原子数②<④<③<① |
17.下列行为符合安全要求的是( )
| A. | 配制稀硫酸时将水倒入浓硫酸中并不断搅拌 | |
| B. | 不慎洒出的酒精在桌上着火时,立即用水扑灭 | |
| C. | 大量氯气泄漏时,迅速离开现场并尽量往高处去 | |
| D. | 少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗 |
18.下列关于钠的叙述中,正确的是( )
| A. | 常温下,钠露置在空气中易被氧气氧化为过氧化钠,因此应保存在煤油里 | |
| B. | 钠是强还原剂,它能从盐溶液中置换出金属活动顺序表中排在钠后面的金属 | |
| C. | 钠蒸气充入灯泡中制成钠灯,常用于公路照明 | |
| D. | 金属钠着火时,能用水来灭火 |
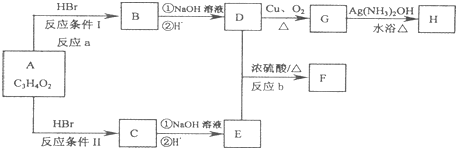
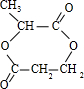 +2H2O
+2H2O