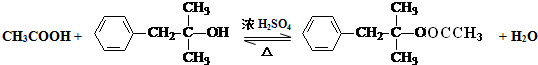
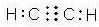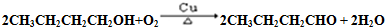题目内容
13.碳及其化合物有广泛的用途.(1)将水蒸气通过红热的碳即可产生水煤气.反应为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,
在一定条件下能说明以上反应达到平衡的是ABCE
A.温度和体积一定,密闭容器中压强不再变化
B.条件一定,混合气体的平均相对分子质量不再变化
C.温度和体积一定,混合气体的密度不再变化
D.生成n mol氢气的同时生成n mol CO
E.2mol H-O键断裂的同时有1mol H-H键的断裂
(2)该反应能够自发进行的反应条件高温
(3)已知:C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的焓变△H=-41.2kJ•mol-1 .
分析 (1)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)△G=△H-T△S<0时,反应自发进行;
(3)①C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,
②C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,依据热化学方程式和盖斯定律②-①得到.
解答 解:(1)A.温度和体积一定,密闭容器中压强不再变化,说明物质的量不变,达平衡状态,故A正确;
B.条件一定,混合气体的平均相对分子质量不再变化,说明气体的质量和物质的量不变,达平衡状态,故B正确;
C.温度和体积一定,混合气体的密度不再变化,说明气体的质量一定,正逆反应速率相等,达平衡状态,故C正确;
D.生成n mol氢气的同时生成n mol CO,都体现正反应方向,未体现正与逆的关系,故D错误;
E.2mol H-O键断裂等效于1mol H-H键的形成同时有1mol H-H键的断裂,正逆反应速率相等,故E正确;
故选:ABCE;
(2)该反应△H>0,△S>0,△G=△H-T△S<0时,反应自发进行,故高温下反应可以自发进行,故答案为:高温;
(3)①C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,
②C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,
依据热化学方程式和盖斯定律②-①得到,CO(g)+H2O(g)?CO2(g)+H2(g),△H=-41.2kJ•mol-1;
故答案为:-41.2kJ•mol-1 .
点评 本题考查反应热的计算、平衡状态判断、反应自发性等,注意掌握化学平衡状态的判断方法,难度中等.

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案| A. | 能发生银镜反应的有机物不一定是醛 | |
| B. | 所有卤代烃都是难溶于水,密度比水小的无色液体 | |
| C. | 可用溴水作试剂除去苯中混有的少量苯酚 | |
| D. | 苯酚有强腐蚀性,沾在皮肤上可用酒精洗涤 |
| A. | 投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO42-、NO3- | |
| B. | 可用稀硝酸除去试管内壁上的银镜 | |
| C. | 1.0 mol•L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO42- | |
| D. | 硫化铜溶于硝酸的离子方程式为CuS+2H+═H2S↑+Cu2+ |
| A. | Cl2 | B. | CO2 | C. | NH3•H2O | D. | AgCl |
 如图中A~G均为中学化学中常见的物质,它们之间有如下转化关系.其中A是天然气的主要成分,B是一种能使带火星木条复燃的气体,C是一种能使澄清石灰石变浑浊的气体,E是一种淡黄色粉末状固体.(反应过程中某些产物已略去)请回答问题:
如图中A~G均为中学化学中常见的物质,它们之间有如下转化关系.其中A是天然气的主要成分,B是一种能使带火星木条复燃的气体,C是一种能使澄清石灰石变浑浊的气体,E是一种淡黄色粉末状固体.(反应过程中某些产物已略去)请回答问题: .
. 现有X、Y、Z三种元素,已知有如下情况:
现有X、Y、Z三种元素,已知有如下情况: