题目内容
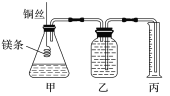
【题目】如图装置甲是某可充电电池的示意图,该电池放电的化学方程式为2K2S2+KI3=K2S4+3KI,图中的离子交换膜只允许K+通过,C、D、F均为石墨电极,E为铜电极。工作一段时间后,断开K,此时C、D两电极产生的气体体积相同,E电极质量减少 1.28 g。

(1)装置甲的A电极为电池的__极,电解质的K+向__(填“左侧”或“右侧”)迁移;B电极的电极反应式为____。
(2)装置乙中D电极析出的气体是___,体积为____mL(标准状况)。
(3)若将装置丙中的NaCl溶液改换成FeCl2和FeCl3的混合溶液。从反应初始至反应结束,丙装置溶液中金属阳离子物质的量浓度与转移电子的物质的量的变化关系如图所示。
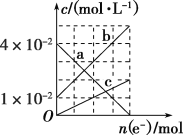
①图中b表示的是_____(填金属离子符号)的变化曲线。
②反应结束后,若用0.5 mol·L-1NaOH溶液沉淀丙装置溶液中的金属阳离子(设溶液体积为100 mL),则至少需要0.5 mol·L-1NaOH溶液______mL。
【答案】负 右侧 I3-+2e-=3I- H2(或氢气) 224 Fe2+ 28
【解析】
本题解题的切入点为E,E质量减轻,则表明E为阳极,发生反应Cu-2e-=Cu2+,E电极质量减少1.28 g,则表明参加反应的Cu为0.02mol,失去电子0.04mol。E为阳极,则F为阴极,A为负极,B为正极,C为阳极,D为阴极。
(1)由上面分析知,装置甲的A电极为电池的负极。因为原电池中,阳离子向正极移动,所以电解质的K+向右侧迁移。B电极为正极,I3-得电子,它的电极反应式为I3-+2e-=3I-。
(2)D电极上首先发生反应Cu2++2e-=Cu,当Cu2+消耗尽时,发生反应2H++2e-=H2↑,所以装置乙中D电极析出的气体是H2(或氢气)。根据得失电子守恒,该电极析出的H2的体积为: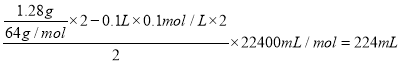 。
。
(3)①若将装置丙中的NaCl溶液改换成FeCl2和FeCl3的混合溶液,则电解时,阳极(E电极)发生反应Cu-2e-=Cu2+,阴极(F电极)发生反应2Fe3++2e-=2Fe2+,故a、b、c分别表示Fe3+、Fe2+、Cu2+的变化曲线。所以图中b表示的是Fe2+的变化曲线。
②由题图中曲线可以看出,反应后溶液中c(Cu2+)=2×10-2 mol·L-1,c(Fe2+)=5×10-2 mol·L-1,c(Fe3+)=0,要使溶液中的金属阳离子完全沉淀,需要n(NaOH)=[n(Cu2+)+n(Fe2+)]×2=(0.02 mol·L-1+0.05 mol·L-1)×0.1 L×2=0.014 mol,V(NaOH)=![]() 。
。

 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案