题目内容
 (2012?汕头二模)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.
(2012?汕头二模)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.(1)工业生产甲醇的常用方法是:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.
已知:2H2(g)+O2(g)=2H2O (l)△H=-571.6kJ/mol
H2(g)+
| 1 |
| 2 |
①H2的燃烧热为
285.8
285.8
kJ/mol.②CH3OH(g)+O2(g)?CO(g)+2H2O(g)的反应热△H=
-392.8KJ/mol
-392.8KJ/mol
.③若在恒温恒容的容器内进行反应CO(g)+2H2(g)?CH3OH(g),则可用来判断该反应达到平衡状态的标志有
AD
AD
.(填字母)A.CO百分含量保持不变
B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变
D.CO的生成速率与CH3OH的生成速率相等
(2)工业上利用甲醇制备氢气的常用方法有两种:
①甲醇蒸汽重整法.该法中的一个主要反应为CH3OH(g)?CO(g)+2H2(g),此反应能自发进行的原因是
该反应是一个熵增的反应
该反应是一个熵增的反应
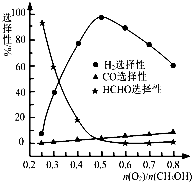
.②甲醇部分氧化法.在一定温度下以Ag/CeO2-ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示.则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为
2CH3OH+O2
2HCHO+2H2O
| 催化剂 |
| 加热 |
2CH3OH+O2
2HCHO+2H2O
;在制备H2时最好控制n(O2)/n(CH3OH)=| 催化剂 |
| 加热 |
0.5
0.5
.(3)在稀硫酸介质中,甲醇燃料电池负极发生的电极反应式为
CH3OH-6e-+H2O=CO2↑+6H+
CH3OH-6e-+H2O=CO2↑+6H+
.分析:(1)①燃烧热是1mo可燃物完全燃烧生成稳定氧化物放出的热量;
②依据盖斯定律和热化学方程式计算得到;
③平衡标志是反应的正逆反应速率相同,各组分浓度保持不变;
(2))①反应为CH3OH(g)?CO(g)+2H2(g),此反应能自发进行的原因是△H-T△S<0,反应是熵增加的反应;
②当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应为甲醇的催化氧化生成甲醛,反应的方程式为:2CH3OH+O2
2HCHO+2H2O;依据图象分析制备氢气时最好是n(O2)/n(CH3OH)=0.5;
(3)酸性介质中,燃料电池,燃料做原电池的负极失电子反应氧化反应,氧气再正极得到电子发生还原反应,甲醇燃烧酸性介质中 生成二氧化碳气体.
②依据盖斯定律和热化学方程式计算得到;
③平衡标志是反应的正逆反应速率相同,各组分浓度保持不变;
(2))①反应为CH3OH(g)?CO(g)+2H2(g),此反应能自发进行的原因是△H-T△S<0,反应是熵增加的反应;
②当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应为甲醇的催化氧化生成甲醛,反应的方程式为:2CH3OH+O2
| 催化剂 |
| 加热 |
(3)酸性介质中,燃料电池,燃料做原电池的负极失电子反应氧化反应,氧气再正极得到电子发生还原反应,甲醇燃烧酸性介质中 生成二氧化碳气体.
解答:解:(1)①根据燃烧热概念,结合热化学方程式,2H2(g)+O2(g)=2H2O (l)△H=-571.6kJ/mol,氢气的燃烧热为:H2(g)+
O2(g)=H2O (l)△H=-285.8kJ/mol,
所以氢气的燃烧热为285.8KJ/mol,故答案为:285.8;
②(1)CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.(2)H2(g)+
O2(g)=H2O(g)△H=-241.8kJ/mol;
(2)×2-(1)得到:CH3OH(g)+O2(g)?CO(g)+2H2O(g)△H=-392.8 kJ/mol,故答案为:-392.8 kJ/mol;
③恒温恒容的容器内进行反应CO(g)+2H2(g)?CH3OH(g)
A、平衡状态各组分的含量不变,证明反应达到平衡,故A正确;
B、氢气和一氧化碳的起始量和消耗量决定,容器中H2浓度与CO浓度相等不能证明反应达到平衡,故B错误;
C、混合气体的密度=
,反应过程中气体质量守恒,容器体积相同,密度不变,不能证明反应达到平衡,故C错误;
D、化学反应速率之比等于化学方程式中计量数之比,CO的生成速率与CH3OH的生成速率相等,说明正逆反应速率相同,故D正确;
故答案为:AD;
(2))①反应为CH3OH(g)?CO(g)+2H2(g),此反应能自发进行的原因是△H-T△S<0,反应是熵增加的反应,故答案为:反应是熵增加的反应;
②当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应为甲醇的催化氧化生成甲醛,反应的方程式为:2CH3OH+O2
2HCHO+2H2O;依据图象分析,在制备H2时最好控制n(O2)/n(CH3OH)=0.5时氢气生成最多,故答案为:2CH3OH+O2
2HCHO+2H2O;0.5;
(3)酸性条件下,负极上甲醇失电子生成二氧化碳和氢离子,电极反应式为CH3OH+H2O-6e-=CO2+6H+,故答案为:CH3OH+H2O-6e-=CO2+6H+.
| 1 |
| 2 |
所以氢气的燃烧热为285.8KJ/mol,故答案为:285.8;
②(1)CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.(2)H2(g)+
| 1 |
| 2 |
(2)×2-(1)得到:CH3OH(g)+O2(g)?CO(g)+2H2O(g)△H=-392.8 kJ/mol,故答案为:-392.8 kJ/mol;
③恒温恒容的容器内进行反应CO(g)+2H2(g)?CH3OH(g)
A、平衡状态各组分的含量不变,证明反应达到平衡,故A正确;
B、氢气和一氧化碳的起始量和消耗量决定,容器中H2浓度与CO浓度相等不能证明反应达到平衡,故B错误;
C、混合气体的密度=
| 气体质量 |
| 气体体积 |
D、化学反应速率之比等于化学方程式中计量数之比,CO的生成速率与CH3OH的生成速率相等,说明正逆反应速率相同,故D正确;
故答案为:AD;
(2))①反应为CH3OH(g)?CO(g)+2H2(g),此反应能自发进行的原因是△H-T△S<0,反应是熵增加的反应,故答案为:反应是熵增加的反应;
②当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应为甲醇的催化氧化生成甲醛,反应的方程式为:2CH3OH+O2
| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
(3)酸性条件下,负极上甲醇失电子生成二氧化碳和氢离子,电极反应式为CH3OH+H2O-6e-=CO2+6H+,故答案为:CH3OH+H2O-6e-=CO2+6H+.
点评:本题考查了燃烧热概念,热化学方程式书写,盖斯定律的应用,化学反应平衡的标志判断,图象分析应用,原电池电极反应书写方法,题目难度中等.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
 (2007?汕头二模)2012年6月16日我国成功发射了“神州九号”.这标志着中国人的太空时代又前进了一大步.发射“神九”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.已知:
(2007?汕头二模)2012年6月16日我国成功发射了“神州九号”.这标志着中国人的太空时代又前进了一大步.发射“神九”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.已知: