题目内容
[2012·汕头二模]下列说法正确的是( )
A. Na、Fe分别与不足量的稀硫酸反应所得溶液均呈中性
B.7.8gNa2O2与CO2完全反应,转移0.2mol电子
C.能通过化合反应制得FeCl2和Fe(OH)3
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
【答案】
C【解析】Fe与不足量的稀硫酸反应生成的FeSO4溶液属于强酸弱碱盐,溶液呈酸性,Na与硫酸反应后得到的Na2SO4溶液为中性,而过量的Na继续与水反应生成NaOH,因此最后溶液显碱性,A项错;Na2O2与CO2反应时,既作氧化剂,又作还原剂,1molNa2O2转移1mol电子,故7.8g(即0.1mol)Na2O2与CO2完全反应转移0.1mol电子,B项错;FeCl2、Fe(OH)3都可通过化合反应Fe+2FeCl3=3FeCl2,4Fe(OH)2+O2+2H2O=4Fe(OH)3制得,C项正确;Na2CO3热稳定性强,受热不分解,D项错。

练习册系列答案
相关题目
 (2007?汕头二模)2012年6月16日我国成功发射了“神州九号”.这标志着中国人的太空时代又前进了一大步.发射“神九”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.已知:
(2007?汕头二模)2012年6月16日我国成功发射了“神州九号”.这标志着中国人的太空时代又前进了一大步.发射“神九”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.已知: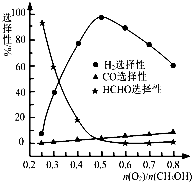 (2012?汕头二模)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.
(2012?汕头二模)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.