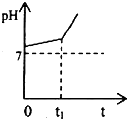
题目内容
1.写出下列有关反应的化学方程式:(1)乙烯与水在一定条件下的加成反应:CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH;
(2)苯的硝化反应:
 ;
;(3)乙酸乙酯在烧碱溶液中的水解:CH3COOC2H5+NaOH→CH3COONa+C2H5OH.
分析 (1)乙烯与水在一定条件下发生加成反应生成乙醇;
(2)苯与浓硝酸在浓硫酸做催化剂、脱水剂条件下发生取代反应生成硝基苯和水;
(3)乙酸乙酯在烧碱溶液中水解生成醋酸钠和乙醇.
解答 解:(1)乙烯与水在一定条件下发生加成反应生成乙醇,化学方程式:CH2=CH2+H2O $\stackrel{一定条件下}{→}$ CH3CH2OH;
CH2=CH2+H2O $\stackrel{一定条件下}{→}$ CH3CH2OH;
(2)苯与浓硝酸在浓硫酸做催化剂、脱水剂条件下发生取代反应生成硝基苯和水,化学方程式 ;
;
故答案为: ;
;
(3)乙酸乙酯在烧碱溶液中的水解生成醋酸钠和乙醇,化学方程式:CH3COOC2H5+NaOH→CH3COONa+C2H5OH;
故答案为:CH3COOC2H5+NaOH→CH3COONa+C2H5OH.
点评 本题考查了化学方程式的书写,明确有机物结构特点是解题关键,注意反应发生的条件.

练习册系列答案
相关题目
11.几种短周期元素的原子半径和主要化合价见下表,下列有关说法中,下列叙述正确的是( )
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
| A. | 单质与氢气化合的难易程度:Z>L | |
| B. | Y的氧化物对应的水化物不能溶于过量的氨水 | |
| C. | Z单质在氧气中燃烧生成ZO3 | |
| D. | L、Q形成的简单离子核外电子数相等 |
10.下列物质中,属于纯净物的是( )
| A. | 溴苯 | B. | 铝热剂 | C. | 石油 | D. | 水煤气 |
11.100mL 6mol•L-1H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量( )
| A. | 碳酸钠(固体) | B. | 少量硫酸铜溶液 | C. | NaCl溶液 | D. | 加热 |
 运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:
运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题: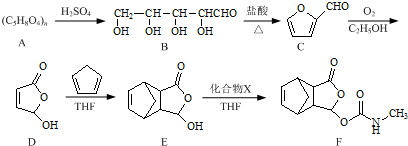
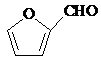 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$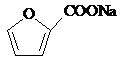 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.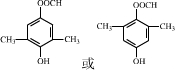 .
.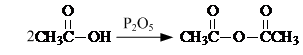 .
.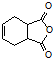 是合成抗病毒药阿昔洛韦的中间体,它可以用
是合成抗病毒药阿昔洛韦的中间体,它可以用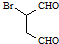 经氧化、消去、成酐一系列反应后再和原料M合成.
经氧化、消去、成酐一系列反应后再和原料M合成.