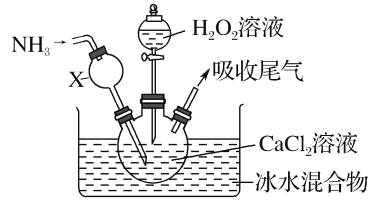
题目内容
【题目】己知A是气态烃,完全燃烧时产生的CO2和,H2O的物质的量之比为1:1,A的相对分子量小于30。在如图所示的变化中,中间产物C跟葡萄糖一样也能银新制的Cu(OH)2发生反应产生砖红色沉淀,E有香味,F是高分子化合物(反应条件未写出)。
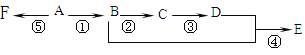
写出下列各步变化的化学方程式及反应类型。
反应①______;_______________
反应②______;________________
反应④______;___________________
反应⑤______;________________
【答案】CH2==CH2+H2O→CH3CH2OH 加成反应 2CH3CH2OH+O2→2CH3CHO+2H2O 氧化反应 CH3COOH+C2H5OH![]() CH3COOC2H5+H2O 取代反应(酯化反应) nCH2=CH2→
CH3COOC2H5+H2O 取代反应(酯化反应) nCH2=CH2→![]() 加聚反应
加聚反应
【解析】
A是气态烃,完全燃烧时产生的CO2和H2O的物质的量之比为1:1,所以A中C、H原子个数比为1:2,A的相对分子量小于30,所以A是乙烯;中间产物C跟葡萄糖一样也能跟新制的Cu(OH)2发生反应产生砖红色沉淀,能和新制氢氧化铜悬浊液产生砖红色沉淀说明C含有醛基,所以C是乙醛,则B是乙醇;E有香味,说明E中含有酯基,羧酸和醇反应生成酯,所以D是乙酸;F是高分子化合物,乙烯发生加聚反应生成聚乙烯,所以F是聚乙烯。反应①:乙烯和水在催化剂条件下发生加成反应生成乙醇,所以反应①的方程式为:CH2 =CH2+H2O→CH3CH2OH;反应②:在铜或银作催化剂、加热条件下,乙醇被氧气氧化生成乙醛,所以反应②的方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;反应④:在浓硫酸作催化剂、加热条件下,乙酸和乙醇反应酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+C2H5OH
2CH3CHO+2H2O;反应④:在浓硫酸作催化剂、加热条件下,乙酸和乙醇反应酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;反应⑤:在一定条件下,乙烯发生加聚反应生成聚乙烯,反应方程式为:n CH2=CH2
CH3COOC2H5+H2O;反应⑤:在一定条件下,乙烯发生加聚反应生成聚乙烯,反应方程式为:n CH2=CH2![]()
![]() ;故答案为:CH2 =CH2+H2O→CH3CH2OH,加成反应;2CH3CH2OH+O2
;故答案为:CH2 =CH2+H2O→CH3CH2OH,加成反应;2CH3CH2OH+O2![]() 2CH3CHO+2H2O,氧化反应;CH3COOH+C2H5OH
2CH3CHO+2H2O,氧化反应;CH3COOH+C2H5OH![]() CH3COOC2H5+H2O,酯化反应;n CH2=CH2
CH3COOC2H5+H2O,酯化反应;n CH2=CH2![]()
![]() ,加聚反应。
,加聚反应。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案