题目内容
【题目】下列关于苯分子结构的说法中,错误的是( )
A.各原子均位于同一平面上,6个碳原子彼此连接成为一个平面正六边形的结构
B.苯环中含有3个C—C单键,3个![]() 双键
双键
C.苯分子中6个碳碳键完全相同
D.苯分子中碳碳之间的键是介于单键和双键之间特殊的键
【答案】B
【解析】
A.苯分子具有平面正六边形结构,6个C原子和6个H原子位于同一平面上,故A正确;
B.苯分子中的碳碳键是介于单键和双键之间特殊的化学键,不存在单纯的单、双键,故B错误;
C.苯分子中的碳碳键是介于单键和双键之间特殊的化学键,分子中6个碳碳键完全相同,故C正确;
D.苯分子中的碳碳键是介于单键和双键之间特殊的化学键,不是单双键交替的结构,分子中6个碳碳键完全相同,故D正确;
故选B。

 ABC考王全优卷系列答案
ABC考王全优卷系列答案【题目】某实验小组学习化学反应速率后,联想到H2O2分解制备氧气,设计如下实验方案探究外界条件对反应速率的影响。
编号 | 温度 | 反应物 | 催化剂 |
甲 | 25℃ | 试管中加入3mL5%H2O2溶液 | 1mL蒸馏水 |
乙 | 25℃ | 试管中加入3mL5%H2O2溶液 | 1mL0.1mol/LFeCl3溶液 |
丙 | 40℃ | 试管中加入3mL5%H2O2溶液 | 1mL蒸馏水 |
(1)实验乙中发生反应的化学方程式为_______________。
(2)实验甲和实验乙的实验目的是____________。实验甲和实验丙的实验目的是___________。
(3)实验过程中该同学对实验乙中产生的气体进行收集,并在2min内6个时间点对注射器内气体进行读数,记录数据如下表。
时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
气体体积/mL | 实验乙 | 15.0 | 29.5 | 43.5 | 56.5 | 69.5 | |
0~20s的反应速率v1=__________mL/s,100~120s的反应速率v2=__________mL/s。不考虑实验测量误差,二者速率存在差异的主要原因是__________。
【题目】氨气是一种用途广泛的化工原料。金属镓是一种广泛用于电子工业和通讯领域的重要金属,镓元素(31Ga)在元素周期表中位于第四周期IIIA族,化学性质与铝元素相似。
(1)下图是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
已知:N2(g)+3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0

①曲线c对应的温度是_____。
②关于工业合成氨的反应,下列叙述正确的是_____(填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.根据勒夏特列原理,一般采用高温下发生反应
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
③工业上合成氨的催化剂为铁触媒,选择温度为500℃的原因是______。
(2)工业上利用Ga与NH3合成固体半导体材料氮化镓(GaN)同时有氢气生成。反应中,生成3molH2时就会放出30.8kJ的热量。
①该反应的热化学方程式是__________。
②该反应的化学平衡常数表达式是_____。
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是_____。
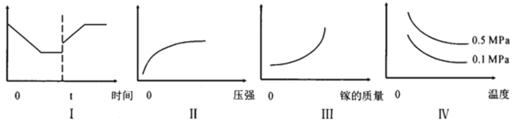
A.I图像中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温
B.II图像中纵坐标可以为镓的转化率
C.III图像中纵坐标可以为化学反应速率
D.Ⅳ图像中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中,该反应的离子方程式是________。
(3)将一块镓铝合金完全溶于烧碱溶液中得到溶液X。己知:
Al(OH)3 | Ga(OH)3 | |
酸式电离常数Ka | 2×10-11 | 1×10-7 |
碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
往X溶液中缓缓通入CO2,最先析出的氢氧化物是_____。