题目内容
【题目】氨气是一种用途广泛的化工原料。金属镓是一种广泛用于电子工业和通讯领域的重要金属,镓元素(31Ga)在元素周期表中位于第四周期IIIA族,化学性质与铝元素相似。
(1)下图是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
已知:N2(g)+3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0

①曲线c对应的温度是_____。
②关于工业合成氨的反应,下列叙述正确的是_____(填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.根据勒夏特列原理,一般采用高温下发生反应
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
③工业上合成氨的催化剂为铁触媒,选择温度为500℃的原因是______。
(2)工业上利用Ga与NH3合成固体半导体材料氮化镓(GaN)同时有氢气生成。反应中,生成3molH2时就会放出30.8kJ的热量。
①该反应的热化学方程式是__________。
②该反应的化学平衡常数表达式是_____。
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是_____。
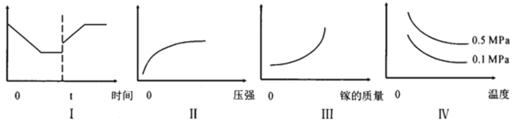
A.I图像中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温
B.II图像中纵坐标可以为镓的转化率
C.III图像中纵坐标可以为化学反应速率
D.Ⅳ图像中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中,该反应的离子方程式是________。
(3)将一块镓铝合金完全溶于烧碱溶液中得到溶液X。己知:
Al(OH)3 | Ga(OH)3 | |
酸式电离常数Ka | 2×10-11 | 1×10-7 |
碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
往X溶液中缓缓通入CO2,最先析出的氢氧化物是_____。
【答案】600℃ AC 500℃时,催化剂活性最大 2Ga(s)+2NH3(g)=2GaN(s)+3H2(g) △H=-30.8kJ/mol 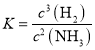 A GaN+H2O+OH–=NH3↑+GaO2– Al(OH)3
A GaN+H2O+OH–=NH3↑+GaO2– Al(OH)3
【解析】
(1)根据已知条件,压强不变时,随着温度的升高,该反应向逆反应方向进行,NH3的物质的量分数越小,由此进行分析判断。
(2)根据题给信息,写出反应的热化学方程式,进而进行分析判断。
(3)根据已知条件,Al(OH)3和Ga(OH)3酸式电离常数Ka[Al(OH)3]<Ka[Ga(OH)3],分析向X溶液中缓缓通入CO2时,最先析出的氢氧化物。
(1)①该可逆反应为放热反应,压强不变时,随着温度的升高,该反应向逆反应方向进行,NH3的物质的量分数越小,分析题给示意图,可知曲线c对应的温度为600℃;
②结合可逆反应的特点进行判断:
A.及时分离出NH3,减小了生成物的浓度,反应物浓度无变化,使得v正>v逆,反应向正反应方向进行,可以提高H2的平衡转化率,A项正确;
B.该可逆反应为放热反应,温度越高,越不利于反应向正反应方向进行,B项错误;
C.平衡常数K只与温度有关,温度不变,K值不变。对于该可逆反应来说,温度越高,K值越小,图中M、Q点温度相同,N点温度大于M、N点温度,故平衡常数K的大小关系是K(M)=K(Q)>K(N),C项正确;
答案选AC;
③催化剂铁触媒在500℃的活性最大,故选择温度为500℃;
(2)①由题给信息可知,反应的热化学方程式为:2Ga(s)+2NH3(g)=2GaN(s)+3H2(g) △H=-30.8kJ/mol;
②根据化学平衡常数的定义,可知该反应的平衡常数表达式为: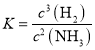 ;
;
③该可逆反应是正反应为气体分子数增大的放热反应,结合该可逆反应的特点进行
A.I图像中如果纵坐标为正反应速率,升高温度或增大压强,反应速率加快,图像符合题意,A项正确;
B.增大压强,平衡向气体体积减小的方向移动,即逆向移动,Ga的转化率降低,B项错误;
C.Ga为固态,其浓度是个定值,加入Ga,反应物的浓度不变,化学反应速率不变,C项错误;
D.相同压强下,升高温度,平衡逆向移动,平均相对分子质量增大,图像中曲线的变化趋势应是随着温度升高而增大;相同温度下,增大压强,平衡逆向移动,平均相对分子质量增大,由此可知,D项错误;
答案选A;
④氮化镓(GaN)溶解在热的NaOH溶液应生成氨气和NaGaO2,则离子方程式为:GaN+H2O+OH–=NH3↑+GaO2–;
(3)所得溶液中存在平衡:H++H2O+GaO2–![]() Ga(OH)3,H++H2O+AlO2–
Ga(OH)3,H++H2O+AlO2–![]() Al(OH)3,Al(OH)3的电离平衡常数更小,故往X溶液中缓缓通入CO2,最先析出的氢氧化物是Al(OH)3。
Al(OH)3,Al(OH)3的电离平衡常数更小,故往X溶液中缓缓通入CO2,最先析出的氢氧化物是Al(OH)3。