题目内容
4.在含有NaI、Na2SO3和FeBr2各1mol的溶液中通入足量的Cl2,将溶液在空气中加热蒸干并充分灼烧,最终得到剩余的固体物质是( )| A. | NaCl、FeCl3、Na2SO4、I2 | B. | NaCl、FeBr3、Na2SO4 | ||
| C. | NaCl、Fe2O3、Na2SO4 | D. | NaBr、FeCl3 |
分析 在含有NaI、Na2SO3和FeBr2 各1mol的溶液中通入足量的Cl2,发生的反应为2NaI+Cl2=2NaCl+I2、Na2SO3+Cl2+H2O=Na2SO4+2HCl、2FeBr2+3Cl2=2FeCl3+2Br2,FeCl3+3H2O?Fe(OH)3+3HCl、2 Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,碘、溴、HCl都具有挥发性,据此分析解答.
解答 解:在含有NaI、Na2SO3和FeBr2 各1mol的溶液中通入足量的Cl2,发生的反应为2NaI+Cl2=2NaCl+I2、Na2SO3+Cl2+H2O=Na2SO4+2HCl、2FeBr2+3Cl2=2FeCl3+2Br2,FeCl3+3H2O?Fe(OH)3+3HCl、2 Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,碘、溴、HCl都具有挥发性,所以剩余固体是NaCl、Fe2O3、Na2SO4,故选C.
点评 本题考查氧化还原反应,明确物质的性质及物质之间的反应是解本题关键,注意卤素单质的性质,题目难度不大.

练习册系列答案
相关题目
15.能一次区分乙酸、乙醇、苯三种物质的是( )
| A. | 水 | B. | 碳酸钠溶液 | C. | 溴水 | D. | 汽油 |
12.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确是( )
①生成物的质量分数一定增加
②生成物的产量一定增大
③反应物的转化率一定增大
④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥使用了合适的催化剂.
①生成物的质量分数一定增加
②生成物的产量一定增大
③反应物的转化率一定增大
④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥使用了合适的催化剂.
| A. | ①② | B. | ②③⑤ | C. | ⑤ | D. | ④⑥ |
19.已知某化学反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•C({H}_{2})}{c(CO)•c({H}_{2}O)}$,在不同的温度下该反应的平衡常数值分别为:
下列有关叙述不正确的是( )
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 该反应的化学方程式是:CO (g)+H2O (g)?CO2 (g)+H2(g) | |
| B. | 上述反应的正反应是放热反应 | |
| C. | 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol时,该反应为平衡状态 | |
| D. | 某温度下,如果平衡浓度符合下列关系式:$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,判断此时的温度是1000℃ |
9.某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L.
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
Ⅳ. 向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+(写离子符号).
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为3NO2+H2O═2HNO3+NO
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Cu2+;,阴离子是Cl-、NO3-、SO42-.(写离子符号)
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为1.6 g.
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl-CO32- NO3- SO42- SiO32- |
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
Ⅳ. 向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+(写离子符号).
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为3NO2+H2O═2HNO3+NO
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Cu2+;,阴离子是Cl-、NO3-、SO42-.(写离子符号)
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为1.6 g.
16.五倍子是一种常见的中草药,其有效成分为X.在一定条件下X可分别转化为Y、Z.下列说法错误的是( )
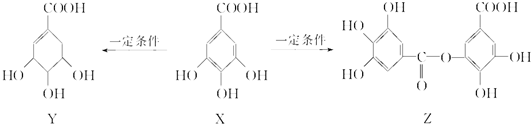

| A. | 1 mol X最多能与2 mol Br2发生取代反应 | |
| B. | Y分子结构中有3个手性碳原子 | |
| C. | 1 mol Z最多能与7 mol NaOH发生反应 | |
| D. | Y能发生加成、取代、消去、氧化、缩聚反应 |
14.下列关于如图所示原电池装置的叙述中,正确的是( )
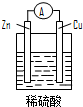

| A. | 铜片是负极 | B. | 铜片表面反应为:Cu-2e- Cu2+ | ||
| C. | 电流从锌片经导线流向铜片 | D. | 氢离子在铜片表面被还原 |
 1,2,3-三苯基环丙烷的3个苯基可以分布在环丙环平面的上下,因此有如下2个异构体.[Φ是苯基,环用键线表示,C、H原子都未画出]据此,可判断1,2,3,4,5-五氯环戊烷(假定五个碳原子也处于同一平面上)的异构体数是( )
1,2,3-三苯基环丙烷的3个苯基可以分布在环丙环平面的上下,因此有如下2个异构体.[Φ是苯基,环用键线表示,C、H原子都未画出]据此,可判断1,2,3,4,5-五氯环戊烷(假定五个碳原子也处于同一平面上)的异构体数是( )