题目内容
15.能一次区分乙酸、乙醇、苯三种物质的是( )| A. | 水 | B. | 碳酸钠溶液 | C. | 溴水 | D. | 汽油 |
分析 乙酸与碳酸氢钠反应生成气体,乙醇与碳酸氢钠溶液不反应不分层,苯与碳酸氢钠溶液不反应但分层,现象不同,以此来解答.
解答 解:A.乙醇、乙酸与水均不反应不分层,现象相同,不能区分,故A错误;
B.乙酸与碳酸钠反应生成气体,乙醇与碳酸钠溶液不反应不分层,苯与碳酸钠溶液不反应但分层,现象不同,能区分,故B正确;
C.乙酸、乙醇与溴水均不反应不分层,现象相同,不能区分,故C错误;
D.三种物质与汽油均不反应不分层,现象相同,不能区分,故D错误;
故选B.
点评 本题考查有机物的鉴别,侧重有机物的密度及溶解性的考查,注意现象不同能区分,题目难度不大.

练习册系列答案
相关题目
5. 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
已知:
①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+1212O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)氢气的燃烧热为△H=-285.8kJ•mol-1,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+3232O2(g)═CO(g)+2H2O(l)△H=-607.6kJ•mol-1.
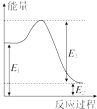
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=0.75时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ B.E2=36kJ
C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)═CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如下表:
则△H1=-116kJ•mol-1,在相应的反应条件下,将1mol CO(g)与足量H2混合充分反应后,放出或吸收的热量<△H1.(用>,<或=填空)
 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+1212O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)氢气的燃烧热为△H=-285.8kJ•mol-1,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+3232O2(g)═CO(g)+2H2O(l)△H=-607.6kJ•mol-1.
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=0.75时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ B.E2=36kJ
C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)═CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
6.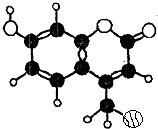 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成.其一溴代物的分子球棍型如图所示,下列有关该溴代物的叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成.其一溴代物的分子球棍型如图所示,下列有关该溴代物的叙述正确的是( )
①该分子的核磁共振氢谱共有5种吸收峰
②能与溴水发生取代反应
③1mol该物质最多能与4molH2加成
④能使酸性KMnO4溶液褪色
⑤1mol该物质最多能与含3mol NaOH的溶液反应.
 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成.其一溴代物的分子球棍型如图所示,下列有关该溴代物的叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成.其一溴代物的分子球棍型如图所示,下列有关该溴代物的叙述正确的是( )①该分子的核磁共振氢谱共有5种吸收峰
②能与溴水发生取代反应
③1mol该物质最多能与4molH2加成
④能使酸性KMnO4溶液褪色
⑤1mol该物质最多能与含3mol NaOH的溶液反应.
| A. | ①②③ | B. | ③④⑤ | C. | ②③④ | D. | ②③④⑤ |
3.已知断裂1mol C-H键,要吸收热量414.4kJ;断裂1mol C-C键,要吸收热量347.4kJ;生成1mol C═C键,会放出热量615.3kJ;生成1mol H-H键,会放出热量435.3kJ,某有机物分解的反应可表示为:

若在反应中消耗了1mol乙烷,则有关该反应的说法正确的是( )

若在反应中消耗了1mol乙烷,则有关该反应的说法正确的是( )
| A. | 该反应放出251.2 kJ的热量 | B. | 该反应吸收251.2 kJ的热量 | ||
| C. | 该反应放出125.6 kJ的热量 | D. | 该反应吸收125.6 kJ的热量 |
10.下列有机物的命名正确的是( )
| A. |  2-乙基丙烷 | B. |  3-丙基-3-戊烯 | C. |  2,4-二硝基苯酚 | D. |  2,3-丁二醇 |
7.a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示.
请回答:
(1)d属于d区的元素,其基态原子的价电子排布图为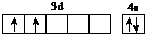 .
.
(2)b与其同周期相邻元素第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)c的氢化物水溶液中存在的氢键有4种,任意画出一种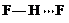 、
、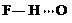 、
、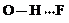 、
、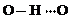 任意一种.
任意一种.
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为SiO2>CO2(用化学式表示).若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为平面三角形;A的中心原子的轨道杂化类型为sp2杂化;与A互为等电子体的一种分子为SO3(填化学式).
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为H4Cu3Au,若该晶体的相对分子质量为M,密度为ag/cm3,则晶胞的体积为MaNAMaNAcm3(NA用表示阿伏加德罗常数的值).
| a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 在周期表所列元素中电负性最大 |
| d | 位于周期表中第4纵行 |
| e | 基态原子M层全充满,N层只有一个电子 |
(1)d属于d区的元素,其基态原子的价电子排布图为
 .
.(2)b与其同周期相邻元素第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)c的氢化物水溶液中存在的氢键有4种,任意画出一种
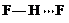 、
、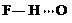 、
、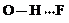 、
、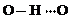 任意一种.
任意一种.(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为SiO2>CO2(用化学式表示).若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为平面三角形;A的中心原子的轨道杂化类型为sp2杂化;与A互为等电子体的一种分子为SO3(填化学式).
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为H4Cu3Au,若该晶体的相对分子质量为M,密度为ag/cm3,则晶胞的体积为MaNAMaNAcm3(NA用表示阿伏加德罗常数的值).
4.在含有NaI、Na2SO3和FeBr2各1mol的溶液中通入足量的Cl2,将溶液在空气中加热蒸干并充分灼烧,最终得到剩余的固体物质是( )
| A. | NaCl、FeCl3、Na2SO4、I2 | B. | NaCl、FeBr3、Na2SO4 | ||
| C. | NaCl、Fe2O3、Na2SO4 | D. | NaBr、FeCl3 |
5.一定量的甲烷燃烧后得到CO、CO2及水蒸气,混合气共重49.6g,通过无水CaCl2时,CaCl2增重25.2g,则CO2的质量为( )
| A. | 12.5 g | B. | 13.2 g | C. | 19.7 g | D. | 24.4 g |
 (1)请指出锌电极和c电极的电极名称:(正、负、阴、阳)
(1)请指出锌电极和c电极的电极名称:(正、负、阴、阳)