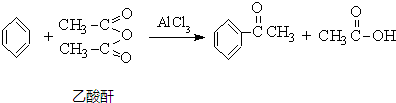
题目内容
5.有两种比较活泼的二价金属A和B,将它们按物质的量之比为1:2混合的44.25克的混合物.此混合物和足量的盐酸反应,共生成16.8L(标准状况)氢气,若将混合物中的A单独跟足量的硝酸银溶液反应,析出的银比溶解的A多了37.75克.求A,B的相对原子质量?分析 根据n=$\frac{V}{{V}_{m}}$计算出标况下16.8L氢气的物质的量,根据电子守恒可知混合金属的总物质的量等于氢气的物质的量;根据二者的物质的量之比可分别计算出A、B的物质的量,再根据A与置换出的银的质量关系计算出A的相对原子质量;最后根据混合物总质量列式计算出B的原子量即可.
解答 解:标况下16.8L氢气的物质的量为:$\frac{16.8L}{22.4L/mol}$=0.75mol,由于A、B都是二价金属,则金属的总物质的量为0.75mol,
则混合物中A的物质的量为:0.75mol×$\frac{1}{3}$=0.25mol,B的物质的量为:0.75mol-0.25mol=0.5mol,
0.25mol+2价的A与足量硝酸银溶液反应置换成的Ag的物质的量为:0.25mol×2=0.5mol,0.5molAg的质量为:108g/mol×0.5mol=54g,
析出的银比溶解的A多了37.75克,则0.25molA的质量为:54g-37.75g=16.25g,
则A的摩尔质量为:$\frac{16.25g}{0.25mol}$=65g/mol,所以A的相对原子质量为65;
设B的相对原子质量为x,根据混合金属的质量可得:16.25g+0.5x=44.25,
解得:x=56,
答:A,B的相对原子质量分别为65、56.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握质量守恒定律、电子守恒等知识在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
15.在相同的温度和压强下,4个容积相同的容器中分别装有4种气体:a.CO2、b.O2 、c.N2 、d.CH4 ,则4个容器中气体的质量由大到小的顺序是( )
| A. | c>d>b>a | B. | b>a>d>c | C. | a>b>c>d | D. | d>c>a>b |
13.在标准状况下,n mL某气体的质量为m g,则该气体的式量为( )
| A. | $\frac{22.4m}{n}$ | B. | $\frac{22400m}{n}$ | C. | $\frac{22400n}{m}$ | D. | $\frac{n}{22.4m}$ |
20.某种抗病毒药物M中含有C、H、O、N等元素,已知0.125mol药物M的质量是22.5g,则药物M的摩尔质量是( )
| A. | 225g•mol-1 | B. | 180g•mol-1 | C. | 90g•mol-1 | D. | 45g•mol-1 |
20.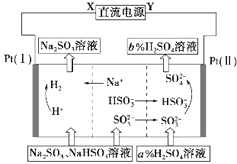 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )
 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )| A. | X为直流电源的负极,Y为直流电源的正极 | |
| B. | 阳极区pH增大 | |
| C. | 阴极区的电极反应为:2H++2e=H2↑ | |
| D. | 该过程中可以循环利用的物质是Na2SO3 |
1.若NA表示阿伏伽德罗常数,下列叙述中正确的是( )
| A. | 1mol含8个碳原子的某烃分子,最多形成8mol碳碳单键 | |
| B. | 7.2 g 过氧化钙(CaO2)固体中阴、阳离子总数为0.2NA | |
| C. | 1 mol Cl2发生反应时,转移的电子数一定是2NA | |
| D. | 精炼铜过程中阳极减轻6.4g时,电路中转移电子数一定是0.2NA |
 在273K(即0℃)时,向如图所示的真空密闭容器A中充入0.5g H2时,测得容器内的压强为1.01×105Pa.由此可以判断A容器的体积约为5.6L.若向A中充入的是O2,压强也是1.01×105pa,则充入的O2质量是8g,若向A容器中充入的是C0气体,使容器内压强达到3.03×105Pa.则充入C0气体的质量是21g.
在273K(即0℃)时,向如图所示的真空密闭容器A中充入0.5g H2时,测得容器内的压强为1.01×105Pa.由此可以判断A容器的体积约为5.6L.若向A中充入的是O2,压强也是1.01×105pa,则充入的O2质量是8g,若向A容器中充入的是C0气体,使容器内压强达到3.03×105Pa.则充入C0气体的质量是21g.