题目内容
20.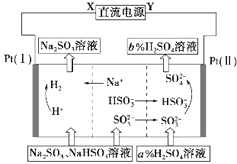 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )| A. | X为直流电源的负极,Y为直流电源的正极 | |
| B. | 阳极区pH增大 | |
| C. | 阴极区的电极反应为:2H++2e=H2↑ | |
| D. | 该过程中可以循环利用的物质是Na2SO3 |
分析 A.根据电解质溶液中阴阳离子的移动方向确定电源的正负极;
B.阳极上亚硫酸根离子被氧化生成硫酸根离子,溶液酸性增强;
C.电解池阴极上氢离子得电子发生还原反应;
D.根据循环再生图确定可以循环利用的物质.
解答 解:A.根据阴阳离子的移动方向知,阳离子向Pt(Ⅰ)电极移动,阴离子向Pt(Ⅱ)移动,因此Pt(Ⅰ)为阴极,Pt(Ⅱ)为阳极,所以X为直流电源的负极,Y为直流电源的正极,故A正确;
B.阳极上,亚硫酸根离子被氧化生成硫酸根离子,亚硫酸是弱电解质,硫酸是强电解质,所以阳极附近氢离子浓度增大,溶液的pH减小,故B错误;
C.该电解池中阴极上生成氢气,应该是氢离子得电子发生还原反应,2H++2e=H2↑,故C正确;
D.根据循环再生图得到:可以循环利用的物质是Na2SO3,故D正确;
故选B.
点评 本题考查学生电解池的工作原理,能正确分析图片是解本题的关键,注意图片中加入物质和析出物质的变化.

练习册系列答案
相关题目
8.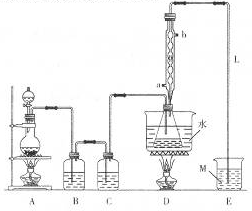 S2Cl2是工业上常用的硫化剂,广泛应用于石油化工.实验室制备S2Cl2的方法有两种:
S2Cl2是工业上常用的硫化剂,广泛应用于石油化工.实验室制备S2Cl2的方法有两种:
①CS2+3Cl2$\stackrel{111-140℃}{→}$CCl4+S2Cl2;②2S+Cl2$\stackrel{95-100℃}{→}$S2Cl2
已知:S2Cl2不稳定,在水中易发生歧化反应(一部分硫元素化合价升高,一部分硫元素化合价降低).
反应涉及的几种物质的熔沸点如下:
实验室利用如下装置制备S2Cl2(部分夹持仪器已略去):
回答下列问题:
(1)写出A装置中发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.如果撤去A装置中酒精灯,若想达到同样的目的,则圆底烧瓶中加入试剂是高锰酸钾(或重铬酸钾,氯酸钾)固体(填写名称).
(2)冷却水进水口是a(填“a”或“b”)
(3)下列均匀为中学教材中的实验,也可以采用类似D装置的冷凝方式的有I、Ⅱ、Ⅳ(填序号)
I.制取溴苯Ⅱ.制取乙酸乙酯Ⅲ.制取氨气Ⅳ.石油分馏
(4)用化学方程式表示撤去C装置的后果2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑;用直接加热替代水浴加热的后果是不易控制温度,温度高时产生副产物,产品纯度降低.
(5)M溶液可以选择下列试剂中的a、c(填序号).
a.碳酸钠溶液 b.氯化铁溶液 c.亚硫酸钠溶液 d.高锰酸钾溶液
(6)实验完毕后,分离产品必需的主要玻璃仪器是蒸馏烧瓶、温度计(填两种仪器名称).
 S2Cl2是工业上常用的硫化剂,广泛应用于石油化工.实验室制备S2Cl2的方法有两种:
S2Cl2是工业上常用的硫化剂,广泛应用于石油化工.实验室制备S2Cl2的方法有两种:①CS2+3Cl2$\stackrel{111-140℃}{→}$CCl4+S2Cl2;②2S+Cl2$\stackrel{95-100℃}{→}$S2Cl2
已知:S2Cl2不稳定,在水中易发生歧化反应(一部分硫元素化合价升高,一部分硫元素化合价降低).
反应涉及的几种物质的熔沸点如下:
| S | CS2 | CCl4 | S2Cl2 | |
| 熔点/ | 113 | -109 | -23 | -77 |
| 沸点/ | 445 | 47 | 77 | 137 |
回答下列问题:
(1)写出A装置中发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.如果撤去A装置中酒精灯,若想达到同样的目的,则圆底烧瓶中加入试剂是高锰酸钾(或重铬酸钾,氯酸钾)固体(填写名称).
(2)冷却水进水口是a(填“a”或“b”)
(3)下列均匀为中学教材中的实验,也可以采用类似D装置的冷凝方式的有I、Ⅱ、Ⅳ(填序号)
I.制取溴苯Ⅱ.制取乙酸乙酯Ⅲ.制取氨气Ⅳ.石油分馏
(4)用化学方程式表示撤去C装置的后果2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑;用直接加热替代水浴加热的后果是不易控制温度,温度高时产生副产物,产品纯度降低.
(5)M溶液可以选择下列试剂中的a、c(填序号).
a.碳酸钠溶液 b.氯化铁溶液 c.亚硫酸钠溶液 d.高锰酸钾溶液
(6)实验完毕后,分离产品必需的主要玻璃仪器是蒸馏烧瓶、温度计(填两种仪器名称).
12.下列方法对2SO2(g)+O2(g)?2SO3(g)(正反应为放热反应)的反应速率没有影响的是( )
| A. | 加入SO3 | B. | 压强不变,充入Ar | C. | 容积不变,充入Ar | D. | 降低温度 |
10.下列关于有机物的说法中,正确的是( )
| A. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| B. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 | |
| C. | 丁烷有3种同分异构体 | |
| D. | 在苯中滴入浓硝酸可制得硝基苯,将铁屑、溴水、苯混合可制得溴苯 |


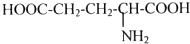 (写结构简式)可以合成二肽(如图2)
(写结构简式)可以合成二肽(如图2)