题目内容
1.若NA表示阿伏伽德罗常数,下列叙述中正确的是( )| A. | 1mol含8个碳原子的某烃分子,最多形成8mol碳碳单键 | |
| B. | 7.2 g 过氧化钙(CaO2)固体中阴、阳离子总数为0.2NA | |
| C. | 1 mol Cl2发生反应时,转移的电子数一定是2NA | |
| D. | 精炼铜过程中阳极减轻6.4g时,电路中转移电子数一定是0.2NA |
分析 A、依据碳原子的最外层电子数是4,可以形成四个单键分析;
B、过氧化钙由钙离子和过氧根构成;
C、依据氯气发生氧化还原反应时,可以是只做氧化剂,也可以自身氧化还原反应分析;
D、依据电解精炼铜的原理和电极反应分析计算.
解答 解:A、1mol含8个碳原子的某烃分子,碳原子形成最多化学键时,都以单键和原子形成,所以8个碳原子最多形成7个碳碳键,故A错误;
B、7.2g过氧化钙的物质的量为0.1mol,而过氧化钙由钙离子和过氧根构成,故0.1mol过氧化钙中含0.2mol离子即0.2NA个,故B正确;
C、1molCl2发生反应时,若只做氧化剂,电子转移为2mol;若1mol氯气自身氧化还原反应,转移电子为1mol,故C错误;
D、电解精炼铜时阳极电极反应Cu-2e-=Cu2+,Fe-2e-=Fe2+,Zn-2e-=Zn2+,Ni-2e-=Ni2+,阴极电极反应为Cu2++2e-=Cu,若阴极得到电子数为0.2NA个,依据电子守恒,阳极失去的电子物质的量为0.2mol,为几种金属共失去的电子,不是铜失电子物质的量,固体质量减少不是6.4g,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
12.下列方法对2SO2(g)+O2(g)?2SO3(g)(正反应为放热反应)的反应速率没有影响的是( )
| A. | 加入SO3 | B. | 压强不变,充入Ar | C. | 容积不变,充入Ar | D. | 降低温度 |
16.下列说法正确的是( )
| A. | 执行“限塑令”主要是为了节约资源 | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 利用丁达尔效应可区分蛋白质溶液与葡萄糖溶液 | |
| D. | 工业生产硫酸中,建立高烟囱可以降低地面SO2的浓度,减少空气污染 |
6.下列应用不涉及氧化还原反应的是( )
| A. | 工业上用石灰乳与氯气制漂白粉 | B. | 工业上电解熔融状态Al2O3制备Al | ||
| C. | 工业上利用合成氨实现人工固氮 | D. | 自来水厂用明矾做净水剂 |
13.降解塑料能在微生物的作用下降解成二氧化碳和水,从而消除废旧塑料对环境的污染.PHB塑料就是一种生物降解塑料,其结构简式为: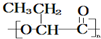 .下面有关PHB的说法不正确的是( )
.下面有关PHB的说法不正确的是( )
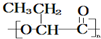 .下面有关PHB的说法不正确的是( )
.下面有关PHB的说法不正确的是( )| A. | PHB是高分子化合物 | |
| B. | 合成PHB的单体是CH3CH2CH(OH)COOH | |
| C. | 通过加聚反应可以制得PHB | |
| D. | 在PHB的降解过程中有氧气参加反应 |
10.下列关于有机物的说法中,正确的是( )
| A. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| B. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 | |
| C. | 丁烷有3种同分异构体 | |
| D. | 在苯中滴入浓硝酸可制得硝基苯,将铁屑、溴水、苯混合可制得溴苯 |
11.下列说法正确的是( )
| A. | C3H6和C4H8一定是同系物 | B. | D和T是同素异形体 | ||
| C. | C2H6和C10H22一定是同系物 | D. | 金刚石和石墨是同位素 |