题目内容
过碳酸钠和盐酸反应的化学方程式为:2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O,商品过碳酸钠中一般都含有Na2CO3,为了测定它的纯度,取一定量的样品和盐酸反应,通过测量产生的氧气的体积,可以计算出过碳酸钠的含量。
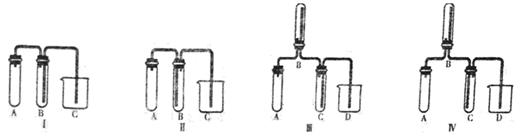
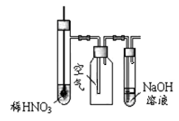
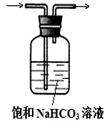
(1)根据下图提供的仪器装置,组装一套测定商品过碳酸钠的实验装置,这些装置的连接顺序是(填接口字母): 。
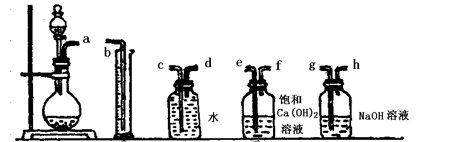
① ② ③ ④ ⑤
(2)装置④的作用是 。
(3)如果实验时,称取w g样品和过量盐酸反应后,测得氧气的体积(标准状况)为V mL,则此样品的纯度为 。
(1)根据下图提供的仪器装置,组装一套测定商品过碳酸钠的实验装置,这些装置的连接顺序是(填接口字母): 。

① ② ③ ④ ⑤
(2)装置④的作用是 。
(3)如果实验时,称取w g样品和过量盐酸反应后,测得氧气的体积(标准状况)为V mL,则此样品的纯度为 。
(9分)
(1) a→g,h→e,f→d,c→b
(2)检验CO2是否完全被吸收
(3)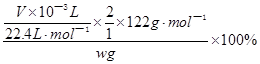
(1) a→g,h→e,f→d,c→b
(2)检验CO2是否完全被吸收
(3)
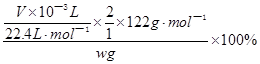
试题分析:(1)过碳酸钠和碳酸钠均能与足量的盐酸反应,放出含有CO2和O2的气体,CO2对O2体积测量有干扰,因此利用排水量气法收集O2之前,需要除去CO2并确认CO2已经被完全除尽;图中几个装置的作用分别是制气、量液或O2的体积、排水集O2、确认是否含有CO2、除去CO2,除去并检验CO2时气体应该长进短出,排水集O2时应短进长出,因此这套装置的连接顺序为a→g,h→e,f→d,c→b;(2)、见(1);(3)、先由n=V/Vm求 n(O2),再由反应式2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O中过碳酸钠与氧气的化学计量数之比等于物质的量之比求 n(Na2CO4),然后再由m=n?M求m(Na2CO4),最后由过碳酸钠的质量和样品的质量求纯度。

练习册系列答案
相关题目
 图I 图II 图III 图IV
图I 图II 图III 图IV