题目内容
【题目】常温下,向10mL0.1mol·![]() 的HA溶液中逐滴滴入0.1mol·
的HA溶液中逐滴滴入0.1mol·![]() 的ROH溶液,所得溶液pH及导电能力的变化如图,下列判断正确的是
的ROH溶液,所得溶液pH及导电能力的变化如图,下列判断正确的是
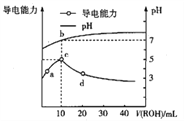
A. ROH在溶液中的电离方程式为![]()
B. c点由![]() 电离出的
电离出的![]() 浓度最小
浓度最小
C. b点存在: ![]()
D. 若升高温度,a、d两点pH增大
【答案】C
【解析】A. 根据图像,加入10mL0.1 mol/L的ROH溶液,恰好生成RA,溶液呈中性,因为0.1 mol/L的HA溶液的pH在6左右,因此HA为弱酸,则ROH为弱碱,ROH在溶液中的电离方程式为ROH![]() R++OH-,故A错误;B. c点为RA溶液,浓度最大,水解促进水的电离,由
R++OH-,故A错误;B. c点为RA溶液,浓度最大,水解促进水的电离,由![]() 电离出的
电离出的![]() 浓度最大,故B错误;C. b点溶液中存在物料守恒:
浓度最大,故B错误;C. b点溶液中存在物料守恒: ![]() ,RA溶液呈中性,说明二者的水解程度相同,因此
,RA溶液呈中性,说明二者的水解程度相同,因此![]() 、
、![]() ,因此
,因此![]() ,故C正确;D. a点酸过量,升高温度,促进酸的电离,溶液的pH减小,d点碱过量,升高温度,促进碱的电离,溶液的pH增大,故D错误;故选C。
,故C正确;D. a点酸过量,升高温度,促进酸的电离,溶液的pH减小,d点碱过量,升高温度,促进碱的电离,溶液的pH增大,故D错误;故选C。

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
【题目】下列离子组在一定条件下能大量共存,且加入相应试剂后所对应的离子方程式正确的是
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A |
| 稀硫酸 |
|
B |
| 氢氧化钠溶液 |
|
C |
| 氢氧化钠溶液 |
|
D |
| 过量氢氧化钠溶液 |
|
A. A B. B C. C D. D