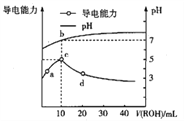
题目内容
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s) + CO2(g)![]() 2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:
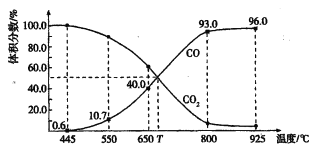
已知:气体分压(P分)=气体总压(p总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,V正、V逆均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为40.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= 23. 04p总
【答案】D
【解析】A,550℃,若充入惰性气体,容器的压强不变,容器的体积增大,相当于减小压强,υ正、υ逆均减小,平衡向正反应方向移动,A项错误;B,由图知650℃时,CO的体积分数为40%,CO2的体积分数为60%,平衡时n(CO2):n(CO)=60%:40%=3:2,设CO2平衡物质的量为3mol,CO平衡物质的量为2mol,生成2molCO消耗1molCO2,反应达到平衡时CO2的转化率为![]() 100%=25%,B项错误;C,T℃平衡时CO与CO2的体积分数相等,若充入等体积的CO2和CO即为平衡状态,平衡不移动,C项错误;D,925℃时CO的体积分数为96%,CO2的体积分数为4%,CO的分压为0.96p总,CO2的分压为0.04p总,用平衡分压代替平衡浓度表示的化学平衡常数Kp=(0.96p总)2
100%=25%,B项错误;C,T℃平衡时CO与CO2的体积分数相等,若充入等体积的CO2和CO即为平衡状态,平衡不移动,C项错误;D,925℃时CO的体积分数为96%,CO2的体积分数为4%,CO的分压为0.96p总,CO2的分压为0.04p总,用平衡分压代替平衡浓度表示的化学平衡常数Kp=(0.96p总)2![]() (0.04p总)=23.04p总;答案选D。
(0.04p总)=23.04p总;答案选D。

练习册系列答案
相关题目