��Ŀ����
����Ŀ��M�ǵ�������Ԫ�أ������ֻ��1�����ӣ�����������ԭ�ӹ�����������ӣ�Ԫ��Y�ĸ�һ�����ӵ��������������������ͬ���ش��������⣺
��1������M�ľ�������Ϊ �� ������ԭ�Ӽ�ͨ�������γ����������ܶѻ�������Mԭ�ӵ���λ��Ϊ ��
��2��Ԫ��Y��̬ԭ�ӵĺ�������Ų�ʽΪ �� ��ͬ����Ԫ���У���һ��������������дԪ�ط��ţ���Ԫ��Y�ĺ������У�������ǿ������д��ѧʽ������������ӵ����幹��Ϊ ��
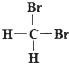
��3��M��Y�γɵ�һ�ֻ����������������ͼ��ʾ�� 
�ٸû�����Ļ�ѧʽΪ �� ��֪��������a=0.542nm���˾�����ܶ�Ϊgcm��3 �� ��д������ʽ����Ҫ��������������ӵ�����ΪNA��
�ڸû�����������ˮ�������ڰ�ˮ����ԭ���� �� �˻�����İ�ˮ��Һ��������������Ϊ����ɫ������ɫ��Һ�������ӵĻ�ѧʽΪ ��
���𰸡�
��1���������壻��������12
��2��1s22s22p63s23p5��Ar��HClO4����������
��3��CuCl��![]() ?��?Cu+���백�γ�������ˮ����λ�����[Cu��NH3��4]2+
?��?Cu+���백�γ�������ˮ����λ�����[Cu��NH3��4]2+
���������⣺��1.��ͭ���ڽ��������������������֮��ͨ�������������һ�𣬾�������Ϊ�������壬ͭ���������������ѻ���������X��Y��Z�����и�ķ���֪��ÿ��ƽ����ͭԭ�ӵ���λ����4�������湲��4��3=12��ͭԭ�ӣ�����ÿ��ͭԭ�ӵ���λ����12�����Դ��ǣ��������壻��������12��
��2.��Ԫ������17��Ԫ�أ�λ�ڵ������ڣ����ݹ���ԭ�����̬�����Ų�Ϊ��1s22s22p63s23p5����ͬ����Ԫ���У���һ������������Ar�����ȵ����и�����������ǿ�Ǻ���������ǿ�ᣬ��ѧʽΪ��HClO4 �� �����������������ԭ��ΪsP3�ӻ���û�й¶Ե����������幹��Ϊ�������壻���Դ��ǣ�1s22s22p63s23p5��Ar�� HClO4�� �������壻
��3.�������ݾ����ṹ�������и������ÿ�������к���ͭԭ�Ӹ���Ϊ��8�� ![]() +6��
+6�� ![]() =4����ԭ�Ӹ���Ϊ4����ѧʽΪ��CuCl��1mol�����к���4molCuCl��1mol����������ΪM��CuCl����4����������a=0.542nm�������ܶ�Ϊ��
=4����ԭ�Ӹ���Ϊ4����ѧʽΪ��CuCl��1mol�����к���4molCuCl��1mol����������ΪM��CuCl����4����������a=0.542nm�������ܶ�Ϊ�� ![]() �����Դ��ǣ�CuCl��
�����Դ��ǣ�CuCl�� ![]() ��
��
��Cu+���백�γ�������ˮ����λ���������CuCl������ˮ�������ڰ�ˮ���û�������Cu+������ΪCu2+ �� ��������ɫ��Һ��������Ϊ��[Cu��NH3��4]2+�����Դ��ǣ�Cu+���백�γ�������ˮ����λ������������ӣ���[Cu��NH3��4]2+ ��

 ����Ӣ��ϵ�д�
����Ӣ��ϵ�д� ����ѧУ�ֲ����ܲ�ϵ�д�
����ѧУ�ֲ����ܲ�ϵ�д�����Ŀ��̼�͵��Ļ����������������й㷺���ڡ��ش���������:
(1)���Ȼ���(NCl3)��һ�ֻ�ɫ����״�����д̼�����ζ�Ļӷ����ж�Һ�壬��ԭ�Ӿ�����8e-�ṹ��д�������ʽ_____________________���ȼҵ����ʱ������ʳ��ˮ��ͨ����������NH4Cl�����������������ɵ�������Ӧ�����������Ȼ������÷�Ӧ�Ļ�ѧ����ʽΪ______________��
(2)һ�������£���ͬ���ʵ�����CO2�벻ͬ�����1.0mol/LNaOH��Һ��ַ�Ӧ�ų����������±���ʾ:
��Ӧ��� | CO2�����ʵ���/mol | NaOH��Һ�����/L | �ų�������/kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
��������CO2��NaOH��Һ��Ӧ����NaHCO3���Ȼ�ѧ��Ӧ����ʽΪ:____________��
(3)����CO���Խ�NOת��Ϊ����N2���䷴ӦΪ��2NO(g)+2CO(g)![]() N2(g)+2CO2(g)�����ݻ���ΪIL�ļס��ҡ�����������(��Ӧ�¶ȷֱ�Ϊ300�桢T�桢300��)�����зֱ������ͬ��NO��CO����ø�������n(CO)�淴Ӧʱ��t�ı仯������±���ʾ:
N2(g)+2CO2(g)�����ݻ���ΪIL�ļס��ҡ�����������(��Ӧ�¶ȷֱ�Ϊ300�桢T�桢300��)�����зֱ������ͬ��NO��CO����ø�������n(CO)�淴Ӧʱ��t�ı仯������±���ʾ:
t/min | 0 | 40 | 80 | 120 | 160 |
n(CO)(������)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(CO)(������)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(CO)(������)/mol | 1.00 | 0.65 | 0.53 | 0.45 |
�ټ������У�0��40min����NO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(NO)=_______��
�ڸ÷�Ӧ�ġ�H______0(�>����<��)��
�۱������ﵽƽ��ʱ��CO��ת����Ϊ____________________________��
(4)�����£���(NH4)2C2O4��Һ�У���ӦNH4++C2O42-+H2O![]() NH3��2H2O+HC2O4-��ƽ�ⳣ��K=___��(��֪�����£�NH3��H2O�ĵ���ƽ�ⳣ��Kb��2��10-5��H2C2O4�ĵ���ƽ�ⳣ��Ka1��5��10-2��Ka2��5��10-5)
NH3��2H2O+HC2O4-��ƽ�ⳣ��K=___��(��֪�����£�NH3��H2O�ĵ���ƽ�ⳣ��Kb��2��10-5��H2C2O4�ĵ���ƽ�ⳣ��Ka1��5��10-2��Ka2��5��10-5)
(5)��ͼ�������Ե������Һ�У������Բ������缫����CO2ת��Ϊ��ϩ��ԭ��ģ�͡�
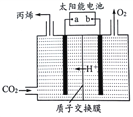
��̫���ܵ�صĸ�����_________��(�a����b��)
�����ɱ�ϩ�ĵ缫��Ӧʽ��____________________________��