��Ŀ����
����Ŀ��������ͼװ�òⶨ�к��ȵ�ʵ�鲽�����£�
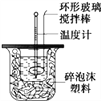
������Ͳ��ȡ50 mL 0.25 mol��L��1���ᵹ��С�ձ��У���������¶ȣ�
������һ��Ͳ��ȡ50 mL 0.55 mol��L��1NaOH��Һ��������һ�¶ȼƲ�����¶ȣ�
�۽�NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ�������Һ����¶ȡ�
�ش��������⣺
��1������NaOH��Һ����ȷ������__________��
A.�ز������������� B���������������� C��һ��Ѹ�ٵ���
��2��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ������________��
A.���¶ȼ�С�Ľ��� B���ҿ�ӲֽƬ�ò���������
C����������ձ� D���������¶ȼ��ϵĻ��β������������ؽ���
��3��ʵ���������±���
������д�±��еĿհף�________��
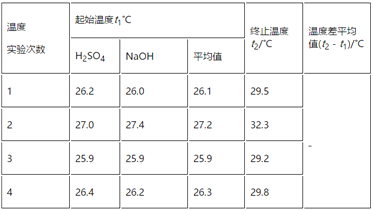
�ڽ�����Ϊ0.55 mol��L��1NaOH��Һ��0.25 mol��L��1������Һ���ܶȶ���1 g��cm��3���кͺ�������Һ�ı�����c��4.18 J��g��1������1�������ϱ����ݼ����к��Ȧ�H��________(ȡС�����һλ)��
���к��Ȳⶨʵ���У����в���һ���ή��ʵ��ȷ�Ե�����______����
A.�õζ��ܣ���������������������0.01��ȡ���������Һ�����
B.NaOH��Һ�ڵ���С�ձ�ʱ������������
C.��С�ձ�������ϴв��ŵ�����ĭ���Ͻ϶�
D.����������Һ���¶ȼ���ˮϴ�����������NaOH��Һ���¶�
���𰸡� C D 3.4 -56.8kJ/mol B
����������1�����������NaOH��ӦѸ�١����ң������ͷŴ����ȣ�һ���Կ��ٵ�����Լ�������ɢ�����������
��2��������NaOH��Һ���ʱ���������¶ȼ��ϵĻ��β������������ؽ�����ʹ������NaOH��Һ��Ͼ��ȣ�
��3�������ж��¶Ȳ����Ч�ԣ�Ȼ������¶Ȳ�ƽ��ֵ��
���ȸ���Q=mc��T���㷴Ӧ�ų���������Ȼ����ݡ�H=-Q/n kJ/mol�������Ӧ�ȣ�
�۸���ʵ��ԭ����ϲ���������
��1������NaOH��Һʱ������һ��Ѹ�ٵĵ��룬Ŀ���Ǽ���������ɢʧ�����ּܷ��ε���NaOH��Һ������ᵼ������ɢʧ��Ӱ��ⶨ�������ѡC��
��2��Ϊʹ��Ӧ��֣�Ӧ�û��β�����������н��裬�¶ȼ��������ⶨ�¶ȵģ������������������������ܴ�ӲֽƬ�����������ʧ�������ձ�������ʹ��Ӧ��ֽ��У���ѡD��
��3����4���¶Ȳ�ֱ�Ϊ��3.4�棬5.1�棬3.3�棬3.5�棬��2��������Ч���¶Ȳ�ƽ��ֵΪ3.4�棻
��50mL 0.25mol/L������50mL 0.55mol/L NaOH��Һ�����кͷ�Ӧ����ˮ�����ʵ���Ϊ0.05L��0.25mol/L��2=0.025mol����Һ������Ϊ100mL��1g/mL=100g���¶ȱ仯��ֵ��T=3.4�棬������0.025molˮ�ų�������ΪQ=mc��T=100g��4.18J/��g�棩��3.4��=1421.2J����1.4212kJ������ʵ���õ��к��ȡ�H=-1.4212kJ/0.025mol=-56.8kJ/mol��
��A. �õζ��ܣ���������������������0.01��ȡ���������Һ����������ڼ��������ʵ��ȷ�ԣ�A�����ϣ�
B. NaOH��Һ�ڵ���С�ձ�ʱ���������������ų����������٣�����ʵ��ȷ�ԣ�B���ϣ�
C. ��С�ձ�������ϴв��ŵ�����ĭ���Ͻ϶������ڱ��£����������ʵ��ȷ�ԣ�C�����ϣ�
D. ����������Һ���¶ȼ���ˮϴ�����������NaOH��Һ���¶ȿ��Լ��������������ʵ��ȷ�ԣ�D�����ϣ���ѡB��



