题目内容
1.用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.
请回答下列问题:
(1)B中选用的试剂是饱和食盐水,其作用是吸收氯化氢;E中选用的试剂是氢氧化钠溶液,其作用是吸收多余氯气.
(2)D中反应的化学方程式是Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2,将此生成物溶于少量水,得到蓝色溶液.
(3)A中制取氯气离子反应方程式:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O.
现将17.4gMnO2与200g 36.5%的浓盐酸(过量)完全反应,把反应后所得溶液稀释到400ml.计算:①生成Cl2的体积(折算成标准状况)为4.48L.
②反应中被氧化的HCl的物质的量为0.4mol.
③稀释后溶液中Cl-的物质的量浓度为4mol/L.
分析 (1)浓盐酸易挥发,从A中制得的氯气含有杂质氯化氢、水蒸气,依次通过盛有饱和食盐水、和浓硫酸的洗气瓶除去,氯气有毒,不能直接排放到空气中,需要进行尾气处理;
(2)铜与氯气反应生成氯化铜;氯化铜溶液为蓝色;
(3)二氧化锰与浓盐酸在加热条件下生成氯化锰、氯气和水;
①盐酸过量,二氧化锰完全反应,计算二氧化锰的物质的量,依据方程式计算生成氯气的体积;
②依据方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知消耗4mol氯化氢,有2mol 被氧化;
③依据氯原子守恒计算剩余氯离子的物质的量,依据C=$\frac{n}{V}$计算氯离子的物质的量浓度.
解答 解:(1)从A中制得的氯气含有杂质氯化氢、水蒸气,依次通过盛有饱和食盐水、和浓硫酸的洗气瓶除去,氯气有毒,不能直接排放到空气中,氯气能够与氢氧化钠溶液反应,被氢氧化钠溶液吸收,可用氢氧化钠进行尾气处理,吸收过量的氯气;
故答案为:吸收氯化氢;氢氧化钠溶液;收多余氯气;
(2)铜与氯气反应生成氯化铜,化学方程式:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2;氯化铜溶液为蓝色;
故答案为:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2; 蓝;
(3)二氧化锰与浓盐酸在加热条件下生成氯化锰、氯气和水,离子方程式:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O;
17.4gMnO2的物质的量:n(MnO2)=$\frac{17.4g}{87g/mol}$=0.2mol;200g 36.5%的浓盐酸中含有氯化氢的物质的量:n(HCl)=$\frac{200g×36.5%}{36.5g/mol}$=2mol,
①依据方程式可得:
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1mol 4 22.4L
0.2mol n V
所以1:0.2=22.4:V,解得V=4,48L;
故答案为:4.48;
②1:0.2=4:n,解得n=0.8mol,所以参加反应的氯化氢的物质的量为0.8mol,依据方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知消耗4mol氯化氢,有2mol 被氧化,所以当消耗0.8mol氯化氢时,被氧化的HCl的物质的量为0.4mol;
故答案为;0.4;
③由Cl元素守恒可知反应后溶液中n(Cl-)=2mol-0.2mol×2=1.6mol,稀释后溶液中Cl-的物质的量浓度为$\frac{1.6mol}{0.4L}$=4 mol/L;
故答案为:4.
点评 本题考查了氯气的制备和有关方程式的计算,明确氯气制备原理和氯气的性质是解题关键,题目难度不大.

 习题精选系列答案
习题精选系列答案| A. | 96倍 | B. | 48倍 | C. | 24倍 | D. | 12倍 |
| A. | ${\;}_{a+2}^{a+b-2}$R | B. | ${\;}_{a-2}^{a+b-2}$R | C. | ${\;}_{b}^{a}$R | D. | ${\;}_{a+2}^{a+b}$R |
| A. | 1.0×10-4 mol/L | B. | 2.0×10-4 mol/L | C. | 1.0×10-5 mol/L | D. | 2.0×10-5 mol/L |
| A. | O2 | B. | CO | C. | CO2 | D. | SO2 |
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 .
.(2)③⑤⑦元素形成的简单离子,离子半径由小到大的顺序Al3+<F-<Cl-(填离子符号)
(3)④⑦元素形成的化合物的电子式为
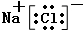 ,②元素形成的单质其结构式为N≡N.
,②元素形成的单质其结构式为N≡N.(4)用化学式,“<”或“>”比较,②③两元素气态氢化物的稳定性NH3<HF;⑥⑦两元素最高价氧化物对应水化物酸性H2SiO3<HClO4.
(5)④⑤两元素最高价氧化物对应水化物发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
| A. | Mg+2H2O$\frac{\underline{\;△\;}}{\;}$Mg(OH)2+H2↑ | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 2K+2H2O═2KOH+H2↑ | D. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ |