题目内容
8.标出下列反应的电子转移方向和数目,并填写有关内容:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
(1)Mn元素得电子,Cl元素被氧化.
(2)氧化剂与还原剂的物质的量比是1:5.
(3)若有7.3gHCl被氧化,产生Cl2的质量为7.1 g.
分析 氧化还原反应中,化合价降低元素得电子,化合价升高元素失去电子,化合价升高数目=化合价降低数目=转移的电子数目;
根据反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中元素化合价的变化,化合价降低的Mn元素所在的反应物KMnO4是氧化剂得电子,化合价升高的Cl元素所在的反应物HCl是还原剂被氧化,对应的产物MnCl2是还原产物,Cl2是氧化产物,据此分析.
解答 解:根据反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中元素化合价的变化,化合价降低的Mn元素所在的反应物KMnO4是氧化剂,化合价升高的Cl元素所在的反应物HCl是还原剂,对应的产物MnCl2是还原产物,Cl2是氧化产物,可得该反应电子转移的方向和数目如下所示: ,故答案为:
,故答案为: ;
;
(1)化合价降低的Mn元素所在的反应物KMnO4是氧化剂得电子,化合价升高的Cl元素所在的反应物HCl是还原剂被氧化,所以Mn元素得电子,Cl元素被氧化,故答案为:Mn;Cl;
(2)化合价降低的Mn元素所在的反应物KMnO4是氧化剂,化合价升高的Cl元素所在的反应物HCl是还原剂,所以氧化剂与还原剂的物质的量比是1:5,故答案为:1:5;
(3)因为HCl是还原剂被氧化,Cl2是氧化产物,所以有7.3gHCl被氧化,产生Cl2的质量为$\frac{7.3g}{36.5g/mol}$×$\frac{1}{2}$×71g/mol=7.1 g,故答案为:7.1 g.
点评 本题考查学生氧化还原反应的有关概念和化学方程式的计算知识,可以根据所学内容来回答,难度不大.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
16.下列说法正确的是( )
| A. | 有机化工原料乙烯可以通过石油分馏大量获得 | |
| B. | 通常情况下丙烷比丁烷更易液化 | |
| C. | 邻二甲苯有两种 | |
| D. | 2-甲基丙烯与1-丁烯不是同系物 |
3.下列各组离子在溶液中可以大量共存的是( )
| A. | Ag+,K+,NO3-,Cl- | B. | Cu2+,Cl-,NO3-,OH- | ||
| C. | Ca2+,Cl-,CO32-,NO3- | D. | Mg2+,Cl-,SO42-,Na+ |
13.下列各组物质中,分子数一定相同的是( )
| A. | 2L CO和2L CO2 | B. | 1mol O2和标况下22.4L H2O | ||
| C. | 0.2mol H2O和4.48L HCl气体 | D. | 9g H2O和0.5mol CO2 |
20.下列离子方程式书写正确的是( )
| A. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O | |
| B. | 稀盐酸与氢氧化钡溶液反应:H++OH-=H2O | |
| C. | 硫酸镁溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| D. | 稀硫酸与氢氧化钡溶液反应:Ba2++OH-+SO42-+H+=Ba SO4↓+H2O |
17.短周期两种元素,它们的原子序数相差2,则( )
| A. | 可能同周期,也可能同主族 | B. | 若一种是F,另一种肯定是Na | ||
| C. | 若一种是Mg,另一种只能是硅 | D. | 一定同周期,不可能同主族 |
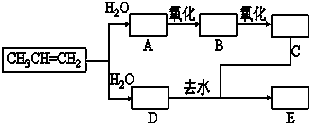 已知:①丙烯与水进行加成反应,其可能的产物有两种;②图中E为开链的酯类化合物,其分子式为C6H12O2.
已知:①丙烯与水进行加成反应,其可能的产物有两种;②图中E为开链的酯类化合物,其分子式为C6H12O2.