题目内容
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为
(2)⑨、=10 ⑩的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑥中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式: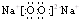
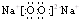 .
.
(4)由表中④、=10 ⑩两种元素形成的氢化物中沸点高的是
| 族 周期 |
IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
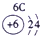
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
Na>O>F
Na>O>F
.(2)⑨、=10 ⑩的最高价含氧酸的酸性由强到弱的顺序是
H2SO4>H3PO4
H2SO4>H3PO4
.(3)①、④、⑥中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式:
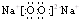
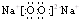
(4)由表中④、=10 ⑩两种元素形成的氢化物中沸点高的是
H2O
H2O
,说明原因:H2O分子间存在氢键
H2O分子间存在氢键
.分析:(1)电子层越多半径越大,电子层一样多的原子,核电荷数越多半径越小;
(2)同一周期元素的原子,从左到右最高价氧化物对应水化物的酸性逐渐增强;
(3)过氧化钠是既含离子键又含共价键的化合物;
(4)水分子间存在氢键,导致水的沸点高.
(2)同一周期元素的原子,从左到右最高价氧化物对应水化物的酸性逐渐增强;
(3)过氧化钠是既含离子键又含共价键的化合物;
(4)水分子间存在氢键,导致水的沸点高.
解答:解:根据元素在周期表中的分布,可以知道①是H,②是C,③是N,④是O,⑤是F,⑥是Na,⑦是Al,⑧是Si,⑨是P,⑩是S.
(1)电子层越多半径越大,所以Na>O、F,电子层一样多的原子,核电荷数越多半径越小,即O>F,故答案为:Na>O>F;
(2)S、P是同一周期元素的原子,根据元素周期律:从左到右最高价氧化物对应水化物的酸性逐渐增强,所以酸性:H2SO4>H3PO4,故答案为:H2SO4>H3PO4;
(3)H、O、Na中的Na和O元素组成的过氧化钠、氢元素和钠元素组成的氢氧化钠均是既含离子键又含共价键的化合物,电子式分别为: ,
,
Na+ ,故答案为:
,故答案为: 或Na+
或Na+ ;
;
(4)水和硫化氢均是分子晶体,但是H2O分子间存在氢键,导致水的沸点高于硫化氢,故答案为:H2O;H2O分子间存在氢键.
(1)电子层越多半径越大,所以Na>O、F,电子层一样多的原子,核电荷数越多半径越小,即O>F,故答案为:Na>O>F;
(2)S、P是同一周期元素的原子,根据元素周期律:从左到右最高价氧化物对应水化物的酸性逐渐增强,所以酸性:H2SO4>H3PO4,故答案为:H2SO4>H3PO4;
(3)H、O、Na中的Na和O元素组成的过氧化钠、氢元素和钠元素组成的氢氧化钠均是既含离子键又含共价键的化合物,电子式分别为:
 ,
,Na+
 ,故答案为:
,故答案为: 或Na+
或Na+ ;
;(4)水和硫化氢均是分子晶体,但是H2O分子间存在氢键,导致水的沸点高于硫化氢,故答案为:H2O;H2O分子间存在氢键.
点评:本题考查学生元素周期表的结构和元素周期律知识,属于综合知识的考查,难度较大.

练习册系列答案
相关题目









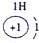
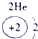
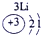
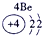
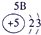
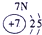
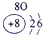
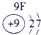
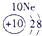
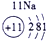





 表示的是
表示的是