题目内容
【题目】将4.9gMg和Fe的混合物在过量的稀硝酸中完全反应,得到标准状况下NO气2.24 L,向反应后的溶液中加入足量的烧碱充分反应,最后生成的沉淀的质量是
A. 8 g B. 10 g C. 10.2 g D. 11.2 g
【答案】B
【解析】n(NO)=0.1mol,生成0.01mol NO,转移的电子的物质的量为:n(e-)=0.1mol×(5-2)=0.3mol,反应中存在:Mg→Mg2+→Mg(OH)2,Fe→Fe3+→Fe(OH)3,得出n(e-)=n(OH-),又m(沉淀)=m(混合物)+m(OH-),所以m(沉淀)=4.9g+0.3mol×17g/mol=10g,故答案为B。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
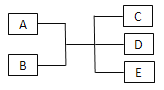
名校联盟快乐课堂系列答案【题目】有A、B、C、D、E五种短周期元素,其元素特征信息如下表,回答下列问题:
元素编号 | 元素特征信息 |
A | 其单质是密度最小的物质 |
B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
D | 其氢氧化物和氧化物都有两性,与C同周期 |
E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:C________,E________;元素E在元素周期表中的位置是__________。
(2)写出A、B、C形成的化合物M的电子式________;B和C的离子中,半径较小的是______(填离子符号 );五种原子中半径最大的是________(填元素符号 )。五种元素最高价氧化物的水化物酸性最强的是(以上填化学式)________________________________。
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为________。
(4)D单质与M的水溶液反应的离子方程式:________。
【题目】某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。

(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_____________。大烧杯如不盖硬纸板,求得的中和热数值将 (填“偏大”、“偏小”或“无影响”)。结合日常生活实际该实验在 中(家用产品)效果更好。
(3)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol-1) 。
(4)取50 mLNaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
试验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
表中的温度差平均值为 ℃。
②近似认为0.50 mol·L-1 NaOH溶液和0.50 molL-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c = 4.18 J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
④实验中改用60mL0.5mol/L盐酸跟50mL0.55 mol·L-1氢氧化钠进行反应,与上述实验相比,所放出的热量 (填相等或不相等,下同),所求的中和热 简述理由 。