题目内容
【题目】十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1)工业上采用NH3-SCR法是消除氮氧化物的常用方法。它利用氨在一定条件下将NOx在脱硝装置中转化为N2。主要反应原理为:
主反应:a. 4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH1;
4N2(g)+6H2O(g) ΔH1;
副反应:b. 4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH2=-1267.1kJ/mol;
2N2(g)+6H2O(g) ΔH2=-1267.1kJ/mol;
c. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH3=-907.3kJ/mol
4NO(g)+6H2O(g) ΔH3=-907.3kJ/mol
①主反应的ΔH1=____________。
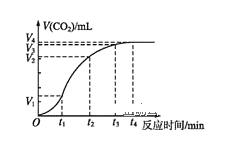
②将氮氧化合物按一定的流速通过脱硝装置,测得出口的NO残留浓度与温度的关系如图所示,试分析脱硝的适宜温度是______(填序号)。

a.<850℃ b.900~1000℃ c.>1050℃
温度超过1000℃,NO浓度升高的原因是_______________。
(2)已知:8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如上如图所示。该反应活化能Ea(A)、Ea(B)、Ea(C)由小到大的顺序是____________,理由是___________。
7N2(g) +12H2O(l) ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如上如图所示。该反应活化能Ea(A)、Ea(B)、Ea(C)由小到大的顺序是____________,理由是___________。

(3)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。若在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。若在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =___________。(用分数表示)
=___________。(用分数表示)
【答案】-1626.9kJ/mol b 温度超过1000时,氨气和氧气反应生成NO,导致NO浓度增大 Ea(A)<Ea(B)<Ea(C) 相同时间内生成氮气的物质的量越多,则反应速率越快,该反应的活化能越低 ![]()
【解析】
(1)①根据已知热化学方程式并结合盖斯定律,可知主反应a=2b-c,进而计算a的反应热;
②氮氧化合物的残留浓度越低越好,并结合图象分析;温度超过1000℃时,氨气和氧气反应生成NO,导致NO浓度增大;
(2)相同时间内生成的氮气物质的量越多,则反应速率越快,该反应的活化能越低,再结合图象分析;
(3)根据已知信息列出三段式计算平衡时刻各物质的浓度,根据平衡时,v正= v逆,即k正·c2(NO)·c2(CO)= k逆·c(N2)·c2(CO2),可得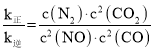 ,代入数据计算。
,代入数据计算。
(1)①根据已知热化学方程式,副反应:b. 4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH2=-1267.1kJ/mol;c. 4NH3(g)+5O2(g)
2N2(g)+6H2O(g) ΔH2=-1267.1kJ/mol;c. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH3=-907.3kJ/mol;结合盖斯定律,可得主反应:a. 4NH3(g)+4NO(g)+O2(g)
4NO(g)+6H2O(g) ΔH3=-907.3kJ/mol;结合盖斯定律,可得主反应:a. 4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)可由2b-c得到,则ΔH1=2ΔH2-ΔH3= -1267.1kJ/mol×2-(-907.3kJ/mol)=-1626.9 kJ/mol;
4N2(g)+6H2O(g)可由2b-c得到,则ΔH1=2ΔH2-ΔH3= -1267.1kJ/mol×2-(-907.3kJ/mol)=-1626.9 kJ/mol;
故答案为:-1626.9kJ/mol;
②氮氧化合物的残留浓度越低越好,根据图可知,在900~1000℃时氮氧化合物的残留浓度最低,则脱硝的适宜温度是900~1000℃;温度超过1000℃时,氨气和氧气反应生成NO,导致NO浓度增大;
故答案为:b;温度超过1000时,氨气和氧气反应生成NO,导致NO浓度增大;
(2)相同时间内生成的氮气物质的量越多,则反应速率越快,该反应的活化能越低,根据图知,化学反应速率A>B>C,所以活化能大小顺序为Ea(A)<Ea(B)<Ea(C);
故答案为:Ea(A)<Ea(B)<Ea(C);相同时间内生成氮气的物质的量越多,则反应速率越快,该反应的活化能越低;
(3)若在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则可列出三段式:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
开始(mol/L):1 1 0 0
变化(mol/L):0.4 0.4 04 0.4
平衡(mol/L):0.6 0.6 0.6 0.6
平衡时,v正= v逆,则k正·c2(NO)·c2(CO)= k逆·c(N2)·c2(CO2),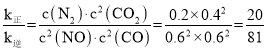 ;
;
故答案为:![]() 。
。

【题目】下列实验的操作、现象和结论(或解释)均正确的是( )
操作 | 现象 | 结论(或解释) | |
A | 向某溶液中滴加Ba(NO3)2溶液和稀盐酸 | 生成白色沉淀 | 原溶液中有SO42- |
B | 密闭容器中有反应:A(g)+B(g) | 再次达到平衡时测得c(C)为0.8mol·L-1 | x=l,增大压强平衡正向移动 |
C | 往试管中加入2mL 10%的CuSO4溶液,再滴入4~6滴2%的NaOH溶液,振荡后加入2mL葡萄糖溶液,加热煮沸 | 产生砖红色沉淀 | 葡萄糖分子结构中有醛基 |
D | 向某溶液中滴加新制氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I- |
A.AB.BC.CD.D
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 | H2C2O4 | K1=5.4×10-2 | H2S | K1=1.3×10-7 |
HClO | 3×10-8 | K2=4.7×10-11 | K2=5.4×10-5 | K2=7.1×10-15 |
请回答下列问题:
(1) 同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是_________。
(2) 0.1mo1/L的H2C2O4溶液与0.1mo1/L的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为________________。
(3)pH相同的NaC1O和CH3COOK溶液中,[c(Na+)-c(C1O-)]______[c(K+)-c(CH3COO-)](填“>”、“<”或“=”) 。
(4) 向0.1mo1/LCH3COOH 溶液中滴加NaOH 溶液至c(CH3COOH): c(CH3COO-)=5:9,此时溶液pH=_________。