题目内容
【题目】(1)在一定温度下的恒容密闭容器中,可逆反应达到平衡状态时,一些宏观物理量恒定不变:a.各物质的浓度不变,b.平衡混合物中各组分的物质的量分数或质量分数不变,c.容器内气体压强不变,d.容器内气体密度不变,e.容器内气体颜色不变。
①能说明反应N2(g)+3H2(g) ![]() 2NH3(g)达到平衡状态的有__;
2NH3(g)达到平衡状态的有__;
②能说明反应H2(g)+I2(g) ![]() 2HI(g)达到平衡状态的有__;
2HI(g)达到平衡状态的有__;
(2)为了研究碳酸钙与盐酸反应的反应速率,某同学通过如图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线。请分析讨论以下问题。
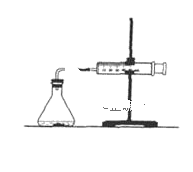
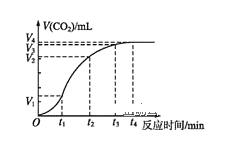
①化学反应速率最快的时间段是___(填选项),影响此时间段反应速率的主要因素是___;
A.O~t1 B.t1~t2 C.t2~t3 D.t3~t4
②为了减缓上述反应速率,欲向盐酸中加入下列物质,你认为可行的有___;
A.蒸馏水 B.NaCl固体 C.NaCl溶液 D.通入HCl气体
【答案】abc abe B 反应放热,使反应速率加快; AC
【解析】
(1)反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量等保持不变,以及由此衍生的一些物理量也不发生变化,由此进行判断。解题时要注意,选择判断的物理量,要随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
(2)①根据图象知,曲线的斜率为该反应的化学反应速率,斜率越大,其反应速率越大;该反应放热,温度升高,反应速率加快;
②降低反应速率,可以通过减小溶液中氢离子浓度实现。
(1)①反应N2(g)+3H2(g)2NH3(g),该反应是反应前后气体体积减小的反应,
a.各物质的浓度不变,b.平衡混合物中各组分的物质的量分数或质量分数不变,c.容器内气体压强不变,d.容器内气体密度不变,e.容器内气体颜色不变。
a. 各物质的浓度不变,说明正逆反应速率相等,达平衡状态,故a正确;
b. 平衡混合物中各组分的物质的量分数或质量分数不变,说明正逆反应速率相等,达平衡状态,故b正确;
c. 随着反应的进行,容器内的压强发生变化,当容器内气体压强不变时,说明达平衡状态,故c正确;
d. 混合气体质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故d错误;
e. 容器内气体颜色不变,整个体系没有颜色,颜色不能作为判断平衡的标志,故e错误;
综上所述,abc能说明该反应达到平衡状态;
故答案为:abc;
②反应H2(g)+I2(g)2HI(g),该反应是反应前后气体体积不变的反应,
a. 各物质的浓度不变,说明正逆反应速率相等,达平衡状态,故a正确;
b. 平衡混合物中各组分的物质的量分数或质量分数不变,说明正逆反应速率相等,达平衡状态,故b正确;
c. 该反应前后气体物质的量不变,随着反应的进行,容器内的压强始终不变,则压强不变不能作为化学平衡状态的判断依据,故c错误;
d. 混合气体质量不变,容器的体积不变,所以混合气体的密度始终不变,所以密度不变不能作为化学平衡状态的判断依据,故d错误;
e. 容器内气体颜色不变,说明碘蒸汽的浓度不变,则正逆反应速率相等,达平衡状态,故e正确;
综上所述,abe能说明该反应达到平衡状态;
故答案为:abe;
(2)①曲线的斜率为该反应的化学反应速率,斜率越大,其反应速率越大,根据图象知,斜率最大的是t1t2;该反应是放热反应,放出的热量使溶液温度升高,升高温度,反应速率加快;
故答案为:B;反应放热,使反应速率加快;
②降低反应速率,可以通过减小溶液中氢离子浓度实现,加水稀释或加入氯化钠溶液都能使氢离子浓度降低,从而降低反应速率,通入氯化氢使溶液中氢离子浓度增大,反应速率加快;故答案为:AC。

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】请按下列要求填空:
(1)已知,NaBH4与水反应:BH4- +2H2O=BO2-+4H2↑(反应实质为水电离出来的H+被还原),反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因___________________________________。
(2)广义的水解观认为:水解的物质和水分别离解成两部分,然后两两重新结合成新的物质,不出现元素化合价的变化.根据以上信息,下列物质水解后的产物错误的是 ___________
①BaO2的水解产物是Ba(OH)2和H2O2 ②PCl3水解的产物是HClO和PH3
③CaC2水解的产物是Ca(OH)2和C2H2 ④Al2S3水解的产物是Al(OH)3和H2S
⑤TiCl4水解产物是TiO2·xH2O和HCl
(3)化学反应可为人类提供能量。已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = -a kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 = -b kJ/mol
③ H2O(g)= H2O(l) ΔH3 = -c kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____________________
(4)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是_________,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______。
A.HCN B.HClO C.CH3COOH D.H2CO3