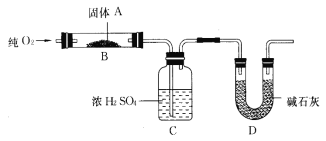
题目内容
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 | H2C2O4 | K1=5.4×10-2 | H2S | K1=1.3×10-7 |
HClO | 3×10-8 | K2=4.7×10-11 | K2=5.4×10-5 | K2=7.1×10-15 |
请回答下列问题:
(1) 同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是_________。
(2) 0.1mo1/L的H2C2O4溶液与0.1mo1/L的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为________________。
(3)pH相同的NaC1O和CH3COOK溶液中,[c(Na+)-c(C1O-)]______[c(K+)-c(CH3COO-)](填“>”、“<”或“=”) 。
(4) 向0.1mo1/LCH3COOH 溶液中滴加NaOH 溶液至c(CH3COOH): c(CH3COO-)=5:9,此时溶液pH=_________。
【答案】 HC2O4- c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) = 5
【解析】(1)一定温度下,弱酸电离常数越大,酸性越强,根据表格数据可知酸性:
H2C2O4>CH3COOH>H2CO3>HClO>HCO3->HS-,酸根离子对应的酸酸性越强,该酸根离子结合氢离子的能力越弱,则同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、C1O-、S2-中结合H+的能力最弱是HC2O4-,故答案为:HC2O4-;
(2)H2C2O4溶液与KOH溶液等浓度等体积混合,二者完全反应生成NaHC2O4和H2O。NaHC2O4溶液中存在三个平衡:HC2O4-C2O42-+H+;HC2O4-+H2OH2C2O4+OH-;H2OH++OH-。溶液呈酸性,则c(H+)>c(OH-),HC2O4-的电离程度大于水解程度,所以c(C2O42-)>c(OH-);又因为H+来自于HC2O4-的电离和水的电离,而C2O42-只来自于HC2O4-的电离,所以c(H+)>c(C2O42-);则溶液中离子浓度大小顺序为:c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)。
(3)NaClO溶液中存在电荷守恒:c(Na+)+ c(H+)= c(ClO-)+ c(OH-),则c(Na+)-c(ClO-)= c(OH-)- c(H+);CH3COOK溶液中存在电荷守恒:c(K+)+ c(H+)= c(CH3COO-)+ c(OH-),则c(K+)-c(CH3COO-)= c(OH-)-c(H+);又因为NaC1O溶液和CH3COOK溶液pH相同,[c(Na+)-c(C1O-)]=[c(K+)-c(CH3COO-)],故答案为:=;
(4)常温下CH3COOH的电离常数Ka=1.8×10-5=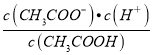 =
=![]() ,所以又则c(H+)=1.0×10-5mol/L;pH=-lg c(H+)=5;故答案为5.
,所以又则c(H+)=1.0×10-5mol/L;pH=-lg c(H+)=5;故答案为5.

【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为_____ (填放热,吸热,无法确定 )反应。
②下列措施能用勒夏特列原理解释是_____(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式_____。
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=_____(用ab表示)。
(4)原料气H2可通过反应 CH4(g)+H2O (g)![]() CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:

①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__(填“增大”,“减小”减小,“不变”不变)。
(5)原料气H2还可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08molL﹣1,该温度下反应的平衡常数K值为_____。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6