题目内容
12.将铁加入到100mL某浓度的盐酸中恰好完全反应,反应后生成的气体为VL(标准状况).将铝加人到100mL 2mol•L-1的NaOH溶液中恰好完全反应,充分反应后生成的气体为3VL.下列说法正确的是( )| A. | 原铁和铝的物质的量相等 | |
| B. | 原盐酸的浓度为2mol•L-1 | |
| C. | 铁加入盐酸中的离子方程式为2Fe+6H+=2Fe3++3H2↑ | |
| D. | 盐酸与氢氧化钠溶液的物质的量浓度之比为1:3 |
分析 Fe与盐酸反应生成氢气的物质的量:n(H2)=$\frac{V}{Vm}$=$\frac{V}{22.4}$mol,由Fe+2HCl=FeCl2+H2↑可求出Fe和盐酸的物质的量;Al与NaOH反应生成氢气的物质的量n(H2)=$\frac{3V}{22.4}$mol,NaOH的物质的量为0.1L×2mol•L-1=0.2mol,由2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,n(Al)=0.2mol,n(H2)=0.3mol,即$\frac{3V}{22.4}$mol=0.3mol,所以V=2.24L,据此结合选项分析.
解答 解:Fe与盐酸反应生成氢气的物质的量:n(H2)=$\frac{V}{Vm}$=$\frac{V}{22.4}$mol,由Fe+2HCl=FeCl2+H2↑可求出Fe和盐酸的物质的量;Al与NaOH反应生成氢气的物质的量n(H2)=$\frac{3V}{22.4}$mol,NaOH的物质的量为0.1L×2mol•L-1=0.2mol,由2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,n(Al)=0.2mol,n(H2)=0.3mol,即$\frac{3V}{22.4}$mol=0.3mol,所以V=2.24L;
A.Fe的物质的量为$\frac{V}{22.4}$mol=0.1mol,Al的物质的量为0.2mol,二者的物质的量不等,故A错误;
B.盐酸的物质的量为$\frac{V}{11.2}$mol=0.2mol,则原盐酸的浓度为$\frac{0.2mol}{0.1L}$=2mol•L-1,故B正确;
C.铁加入盐酸中的离子方程式为Fe+2H+=Fe2++H2↑,故C错误;
D.原盐酸的浓度为$\frac{0.2mol}{0.1L}$=2mol•L-1,氢氧化钠的浓度为2mol•L-1,则盐酸与氢氧化钠溶液的物质的量浓度之比为1:1,故D错误.
故选B.
点评 本题考查了有关方程式的计算,题目难度不大,注意把握Fe与酸以及Al与氢氧化钠的反应,侧重于考查学生的分析能力和计算能力.

 名校课堂系列答案
名校课堂系列答案| A. | 属于高分子化合物 | B. | 能溶解于水 | ||
| C. | 煤焦油的主要成分 | D. | 不能发生取代反应 |
| 甲 | 乙 | ||
| 丙 | 丁 | 戊 |
| A. | 原子半径:丙>丁>戊 | |
| B. | 最高化合价:甲<丁<戊 | |
| C. | 最高价氧化物的水化物的酸性:丙<甲<乙 | |
| D. | 非金属性:乙>丁>丙 |
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
| A. | 偏高 | B. | 偏低 | C. | 不变 | D. | 无法判断 |
| A. | 将0.2mol•L-1氨水与0.2mol•L-1盐酸混合,c(NH3•H20)+c(NH4+)=c(Cl-) | |
| B. | 常温下NH4A溶液中的pH=6,则c(A-)-c(NH4+)=9.9×10-7mol•L-1 | |
| C. | c(NH4+)相等的NH4Cl,NH4HCO3溶液中,溶质初始浓度:c(NH4Cl)=c(NH4HCO3) | |
| D. | 将0.2molCO2缓慢通入含有0.3molNAOH的溶液中,c(CO32-)>c(HCO3-)>c(H2CO3) |
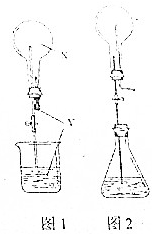 关于喷泉实验,回答下列问题:
关于喷泉实验,回答下列问题: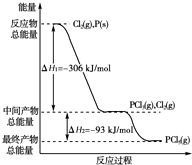 红磷P(s)和Cl2(g)发生反应生成PCl3(g),继续反应生成PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g),继续反应生成PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).