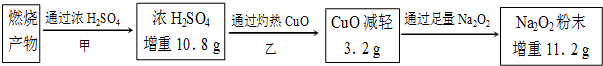
题目内容
11.化合物A是制玻璃的主要原料之一.常温下,化合物B、H、I为气体,B不溶于水,H、I易溶于水,H的水溶液呈碱性,I的水溶液呈酸性.D元素是地壳中含量仅次于氧的非金属元素.化合物J是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中D元素的质量分数为60%.上述物质间的转化关系如图所示.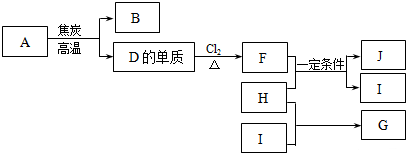
(1)制玻璃的主要原料除A外,还有Na2CO3、CaCO3(填化学式).盛放NaOH溶液的试剂瓶不能用玻璃塞,原因是(用化学方程式表示)SiO2+2NaOH=Na2SiO3+H2O.
(2)D元素在元素周期表中的位置是第三周期ⅣA族.
(3)气体H和气体I相遇时,可观察到的实验现象是有白烟产生.
(4)F和H反应生成J和I反应的化学方程式是3SiCl4+4NH3$\frac{\underline{\;\;△\;\;}}{\;}$Si3N4+12HCl.
(5)下列说法正确的是(填选项序号)ac.
a.上述由A生成D的单质的反应属于置换反应
b.D元素在自然界中主要以单质形式存在
c.G是含有极性共价键的离子化合物
d.I是强电解质,G是弱电解质,二者的水溶液都显酸性.
分析 B不溶于水,且是有毒气体可知B为CO;H的水溶液呈碱性可知H为NH3;化合物A是制玻璃的主要原料之一,且能在在高温下与碳反应,应为SiO2;D元素是地壳中含量仅次于氧的非金属元素,D为Si;由D的单质与Cl2反应生成F可知F为SiCl4,所以I为HCl、J为新型无机非金属材料Si3N4,相对分子质量为140,其中Si元素的质量分数为60%,则H为NH3、G为NH4Cl,结合物质的性质以及题目要求可解答该题.
解答 解:B不溶于水,且是有毒气体可知B为CO;H的水溶液呈碱性可知H为NH3;化合物A是制玻璃的主要原料之一,且能在在高温下与碳反应,应为SiO2;D元素是地壳中含量仅次于氧的非金属元素,D为Si;由D的单质与Cl2反应生成F可知F为SiCl4,所以I为HCl、J为新型无机非金属材料Si3N4,相对分子质量为140,其中Si元素的质量分数为60%,则H为NH3、G为NH4Cl,
(1)制玻璃的主要原料有SiO2、Na2CO3和CaCO3,由于二氧化硅能和氢氧化钠反应生成硅酸钠而导致玻璃塞打不开,发生反应为SiO2+2NaOH=Na2SiO3+H2O,则盛放NaOH溶液的试剂瓶不能用玻璃塞,
故答案为:Na2CO3、CaCO3;SiO2+2NaOH=Na2SiO3+H2O;
(2)D为Si元素,原子序数为14,位于周期表第三周期ⅣA族,
故答案为:第三周期ⅣA族;
(3)H为NH3,I为HCl,氨气与氯化氢相遇会生成氯化铵,有白烟产生,
故答案为:有白烟产生;
(4)由以上分析可知F和H反应生成J和I反应的化学方程式是:3SiCl4+4NH3$\frac{\underline{\;\;△\;\;}}{\;}$Si3N4+12HCl,
故答案为:3SiCl4+4NH3$\frac{\underline{\;\;△\;\;}}{\;}$Si3N4+12HCl;
(5)a.上述由A生成D的单质的反应为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO+Si,属于置换反应,故a正确;
b.Si元素在自然界中主要以化合物形式存在,故b错误;
c.G为NH4Cl,是含有极性共价键的离子化合物,故c正确;
d.HCl和NH4Cl都是强电解质,二者的水溶液都显酸性,故d错误,
故答案为:ac.
点评 本题考查无机物的推断,题目难度中等,侧重于元素化合物知识的考查,本题的突破口为B、H,以及物质之间的转化关系,试题培养了学生灵活应用基础知识的能力及逻辑推理能力.

 阅读快车系列答案
阅读快车系列答案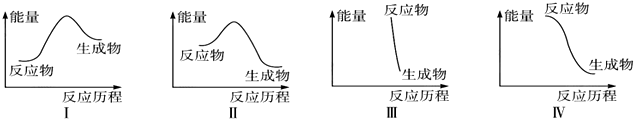
| A. | Ⅰ可表示放热反应 | B. | Ⅱ可表示放热反应 | ||
| C. | Ⅲ可表示爆炸反应 | D. | Ⅳ可表示醋酸和碱的中和反应 |
| A. |  | B. | 乙烷 | C. | 甲烷 | D. | CH3CH=CH2 |
| A. | H2O | B. | 溴水 | ||
| C. | 新制Cu(OH)2 | D. | 酸性高锰酸钾溶液 |
| A. | 苯 | B. | 甲烷 | C. | 乙烯 | D. | 氯化氢 |
 ,该有机物不能发生的反应为( )
,该有机物不能发生的反应为( )| A. | 加成反应 | B. | 消去反应 | C. | 水解反应 | D. | 聚合反应 |
| A. | 甲烷和乙烷 | B. | 乙烯和乙烷 | C. | 乙烷和丙烯 | D. | 甲烷和丙烷 |
| A. | 做菜时用适量的食盐、味精和醋调味 | |
| B. | 把三聚氰胺添加到牛奶中 | |
| C. | 把发霉的大米淘净后做饭 | |
| D. | 把色彩鲜艳的着色剂添加到婴儿食品中 |