题目内容
【题目】德国化学家凯库勒认为苯分子的结构中,碳碳间以单、双键交替结合而成环状。为了评价凯库勒的观点,某学生设计了以下实验方案:
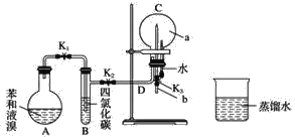
实验操作:
①按如图所示的装置图连接好各仪器;
②检验装置的气密性;
③在A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开K1、K2止水夹,关闭K3止水夹;
④待烧瓶C中气体收集满后,将导管b的下端插入烧杯里的水中,关闭K2,打开K3,挤压预先装有水的胶头滴管的胶头,观察实验现象。
请回答下列问题:
(1)能证明凯库勒观点错误的实验现象是_________。
(2)A中所发生的反应的反应类型为__________。
(3)A中发生反应的化学方程式__________。
(4)装置B的作用是____________。
【答案】C中产生“喷泉”现象 取代反应 ![]() +Br2
+Br2![]()
![]() +HBr 除去未反应的苯蒸气和溴蒸气
+HBr 除去未反应的苯蒸气和溴蒸气
【解析】
(1)依据凯库勒观点,苯环中含有双键,与溴发生加成反应,不会产生溴化氢,不会发生喷泉实验;
(2)(3)苯与溴在铁作催化剂的条件下发生取代反应生成溴苯和溴化氢;
(4)苯与液溴的反应是放热反应,苯与液溴均易挥发,溴的存在干扰检验H+、Br-,苯、溴容易溶于四氯化碳,四氯化碳是常用的有机溶剂。
(1)苯与溴如果发生加成反应,不产生溴化氢,无HBr在水中溶解导致的压强差,就不会发生喷泉实验;如果发生取代反应,则生成溴化氢,溴化氢易溶于水,能够发生喷泉实验,所以只要发生喷泉实验,就可证明苯与溴发生的是取代而不是加成反应,证明不含双键,可以证明凯库勒观点错误;
(2)苯与溴在铁作催化剂的条件下发生取代反应产生溴苯和HBr;
(3)在烧瓶A中发生的化学方程式为:![]() +Br2
+Br2![]()
![]() +HBr;
+HBr;
(4)由于反应放热,且苯与液溴均易挥发,苯和溴极易溶于四氯化碳,用四氯化碳除去溴化氢气体中的溴蒸气和苯,以防止干扰检验H+、Br-。

【题目】高炉炼铁过程中发生的主要反应为:![]() ,已知该反应在不同温度下的平衡常数如下:
,已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式![]() ______,该反应的正反应是______反应(填“放热”、“吸热”)。
______,该反应的正反应是______反应(填“放热”、“吸热”)。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率![]() ______、CO的平衡转化率
______、CO的平衡转化率![]() ______;
______;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是______。
a.减少Fe的量 b.增加Fe2O3的量 c.移出部分CO2 d.提高反应温度e.减小容器的容积 f.加入合适的催化剂
(4)在氯氧化法处理含![]() 的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
①某厂废水中含KCN,其浓度为650mg/L。现用氯氧化法处理,发生如下反应(其中N均为![]() 价):
价):![]() 被氧化的元素是______。
被氧化的元素是______。
②投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目:
□![]() □
□![]() □
□![]() □
□![]() □
□![]() □
□![]() □
□![]() ______
______
③若处理上述废水40L,使KCN完全转化为无毒物质,至少需液氯______g。