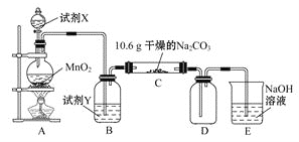
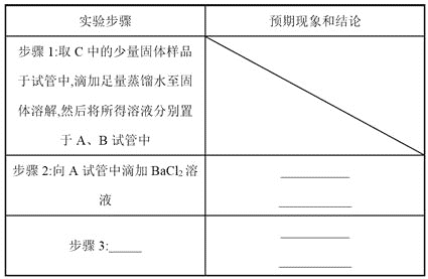
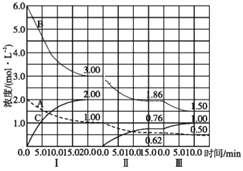
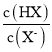题目内容
【题目】某化学兴趣小组要完成中和热的测定实验。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒、0.5 mol·L-1盐酸、0.55 mol·L-1氢氧化钠溶液,实验尚缺少的玻璃用品是___、___。
(2)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
a | 50mL 0.55mol·L-1NaOH溶液 | 50mL0.5mol·L-1HCl溶液 | 20℃ | 23.3℃ | ___ |
b | 50 mL0.55mol·L-1 NaOH溶液 | 50mL0.5mol·L-1 HCl溶液 | 20℃ | 23.5℃ | |
已知:反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1g·cm-3。计算完成表中ΔH=___。
(3)___(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸。
【答案】环形玻璃搅拌棒 温度计 -56.8kJ·mol-1 不能
【解析】
(1)根据中和热测定的实验步骤选用需要的仪器,然后判断还缺少的仪器;
(2)先判断实验数据的有效性,然后求出温度差的平均值,再根据Q=mc△t计算反应放出的热量,然后根据中和热的概念分析判断;
(3)氢氧化钡与硫酸反应生成了硫酸钡沉淀,生成沉淀的过程中会有热量变化,影响测定结果,据此分析判断。
(1)中和热的测定过程中,需要用量筒量取酸溶液、碱溶液的体积,需要使用温度计测量溶液的温度,测量过程中用玻璃棒不断搅拌,所以还缺少的玻璃用品是环形玻璃搅拌棒、温度计,故答案为:环形玻璃搅拌棒;温度计;
(2)2次温度差分别为:3.3℃,3.5℃,2组数据都有效,温度差平均值为3.4℃,50mL0.55molL-1NaOH和50mL.0.5molL-1HCl质量和为m=100mL×1g/mL=100g,c=4.18J/(g℃),△t=3.4℃,根据Q=cm△t,生成0.025mol的水放出热量Q=4.18J/(g℃)×100g×3.4℃=1421.2J=1.4212kJ,即生成0.025mol的水放出热量1.4212kJ,所以生成1mol的水放出热量为![]() =56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol,故答案为:-56.8 kJ·mol-1;
=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol,故答案为:-56.8 kJ·mol-1;
(3)硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,该反应中的生成热会影响反应的反应热,所以不能用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热,故答案为:不能。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】“环境就是民生,青山就是美丽,蓝天也是幸福。“拥有天蓝、地绿、水净的美好家园,是每个中国人的梦想。回答下列问题:
(1)排放到大气中的氮的氧化物,会造成___污染。
(2)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。氨氨废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以NH4+和NH3·H2O形式存在,为达到变废为宝回收利用的目的。可采取的方法是___。
②某团队设计处理流程如下:
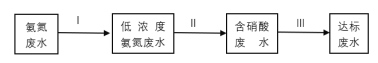
过程Ⅱ为硝化过程,在微生物的作用下实现NH4+→NO2-→NO3-的转化,在碱性条件下NH4+被氧气氧化成NO3-的总反应离子方程式为___。
过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇(CH3OH)实现HNO3→NO2-→N2的转化,将lmol NO2-完全转化为N2,转移的电子数为___。
(3)磷酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产物用于制造石膏。脱硫反应的化学方程式为____。
②某兴趣小组对取得的酸雨样品进行pH测定,随着的简的推移,得到以下数据(pH越小,酸性越强)。
时间/h | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
雨水pH变化的主要原因是___(用化学方程式表示)。
③某硫酸化工厂,使用一种含杂质为25%的黄铁矿石(FeS2)为原料。若取2吨该矿石,可制得98%的浓硫酸___吨(假设生产过程中96%SO2转化为SO3)。