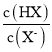题目内容
【题目】雾霾天气严重影响了人们的身体健康,环境问题越来越受到人们的重视。汽车尾气中含有较多的NO和CO,两种气体均会使人体中毒。处理大气中的污染物,打响“蓝天白云”保卫战是当前的重要课题。
请回答下列问题
(1)一氧化碳、氢气既是重要的能源,也可以催化还原NO等消除污染,还可以在一定条件下制取CH3OH。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1;
②2H2(g)+O2(g)=2H2O(1) △H=-571.6kJ·mol-1;
③H2O(g)=H2O(1) △H=-44kJ·mol-1。
写出H2与NO反应生成N2和水蒸气的热化学方程式:__。
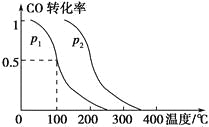
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。在密闭容器中充有10molCO和20molH2,在催化剂作用下发生反应生成甲醇,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。则该反应的△H___0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时平衡常数K=___。
CH3OH(g)。在密闭容器中充有10molCO和20molH2,在催化剂作用下发生反应生成甲醇,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。则该反应的△H___0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时平衡常数K=___。

(3)工业上采用加压条件下,在含冷却装置的吸收塔中,以去离子水为吸收剂吸收NO,得到40%的硝酸。原理如下:
2NO(g)+O2(g)![]() 2NO2(g) △H=-114kJ·mol-1
2NO2(g) △H=-114kJ·mol-1
3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g) △H=-69.92kJ·mol-1
2HNO3(aq)+NO(g) △H=-69.92kJ·mol-1
采用降温操作的一个原因是__。
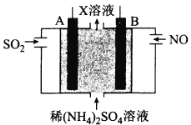
(4)利用电解原理也可以处理工厂烟气。如图为工业生产模拟装置。其中A、B为多孔电极(外接电源未画出),则A为___极(填“正”“负”“阴”或“阳”),电极反应式为___。
【答案】2H2(g)+2NO(g)=2H2O(g)+N2(g) △H=-664.1kJ![]() mol-1 < 1 降低温度平衡正向移动,硝酸高温下易分解 阳极 SO2-2e-+2H2O=SO
mol-1 < 1 降低温度平衡正向移动,硝酸高温下易分解 阳极 SO2-2e-+2H2O=SO![]() +4H+
+4H+
【解析】
(1)已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1;②2H2(g)+O2(g)=2H2O(1) △H=-571.6kJ·mol-1;③H2O(g)=H2O(1) △H=-44kJ·mol-1。根据盖斯定律①-②-2×③得2H2(g)+2NO(g)=2H2O(g)+N2(g)△H=-664.1kJ·mol-1;故答案为:2H2(g)+2NO(g)=2H2O(g)+N2(g)△H=-664.1kJ·mol-1;
(2)根据图可知,随着温度的升高,CO的转化率降低,说明温度升高不利于正反应,即该反应是放热反应,△H<0;
平衡状态A时,CO的转化率为0.5,容器的体积为10L,则有三段式:

则T1时,K=![]() =1,平衡状态B与A温度相同,则K不变。
=1,平衡状态B与A温度相同,则K不变。
故答案为:<;1;
(3)根据反应可知,以去离子水吸收剂吸收NO的反应为放热反应,硝酸高温下易分解,故采用降温操作可以促进反应的进行同时防止硝酸的分解;故答案为:降低温度平衡正向移动,硝酸高温下易分解;
(4)根据图示,总反应为:5SO2+2NO+8H2O=(NH4)2SO4+4H2SO4,则X溶液中的溶质是(NH4)2SO4、H2SO4;A极SO2失去电子发生氧化反应生成SO42-,则A为阳极,电极反应为:SO2-2e-+2H2O=SO![]() +4H+。故答案为:阳;SO2-2e-+2H2O=SO
+4H+。故答案为:阳;SO2-2e-+2H2O=SO![]() +4H+。
+4H+。

 阅读快车系列答案
阅读快车系列答案【题目】将0.2 mol·L-1的KI溶液和0.05 mol·L-1Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是( )
2Fe2++I2”的是( )
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
已知:离子方程式:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓(蓝色沉淀)
A.①B.②和④C.③和④D.①和②