题目内容
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。

回答下列问题:
(1)A与E形成的化合物的化学式是 。
(2)B的最高价氧化物化学式为 ,C的元素名称为 ,
D的单质与水反应的方程式为_ 。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是 ,有关反应的离子方程式为 ; 。
【答案】(1)Al2O3;
(2)P2O5;硫;Cl2+H2O=HCl+HClO;
(3)先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清;Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O。
【解析】试题分析:因A、B、C、D四种短周期元素在图中位置可知,A为第二周期元素,B、C、D为第三周期元素,设C的核外电子数为X,则A、B、D的最外层电子数为分别为X-8,X-1,X+1,所以:X+X-8+X-1+X+1=56,解得X=16,则B为磷,C为硫,D为氯,A为氧;根据E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2,可知E为+3价金属,又E的阳离子与A的阴离子核外电子层结构相同,则E为铝。
(1)因A为氧,E为铝,A与E形成的化合物的化学式是Al2O3,故答案为:Al2O3;
(2)因B为磷元素,所以B的最高价氧化物化学式为P2O5;C为硫;D为氯,其单质与水反应:Cl2+H2O = H++Cl-+HClO,故答案为:P2O5;硫;Cl2+H2O = H++Cl-+HClO;
(3)氢氧化铝为两性氧化物能与碱反应生成盐和水,所以向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清,化学方程式为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O,故答案为:先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清;Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】在通风橱中进行下列实验:
步骤 |
|
| |
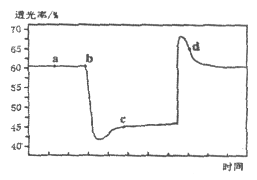
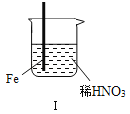
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是( )
A. Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2═2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对此Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是( )
A. T2时,NO2的平衡转化率为70.0%
B. 该反应的△H>0、T1<T2
C. 保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80molH2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小