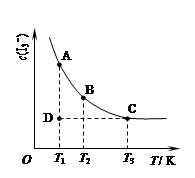题目内容
在C(s)+CO2(g) 2CO(g)反应中可使反应速率增大的措施是
2CO(g)反应中可使反应速率增大的措施是
①减小容器体积使增大压强 ②增加碳的量 ③恒容时通入CO2
④恒压下充入N2 ⑤恒容下充入N2
| A.①③⑤ | B.②④ | C.①③ | D.③⑤ |
C
解析试题分析:①减小容器体积使增大压强,则气体的浓度增大,反应速率增大;②碳为固体,增加碳的量几乎不影响反应速率;③恒容时通入CO2,使CO2浓度增大,反应速率增大;④恒压下充入N2,体积增大,是容器内CO2浓度减小,反应速率减小;⑤恒容下充入N2,气体浓度不变,反应速率不影响。
考点:考查影响化学反应速率的因素。

练习册系列答案
相关题目
反应X(g)+Y(g)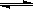 2Z(g); ΔH<0,达到平衡时,下列说法正确的是
2Z(g); ΔH<0,达到平衡时,下列说法正确的是
| A.减小容器体积,平衡向右移动 | B.加入催化剂,Z的产率增大 |
| C.增大c(X),X的转化率增大 | D.降低温度,Y的转化率增大 |
向甲、乙两个容积均为1 L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2 mol SO2、1 mol O2,乙充入1 mol SO2、0.5 mol O2),发生反应:2SO2(g)+O2(g)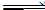 2SO3(g);ΔH=-197.74 kJ·mol-1。
2SO3(g);ΔH=-197.74 kJ·mol-1。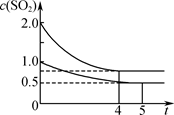
一段时间后达到平衡,测得两容器中c(SO2)(mol·L-1)随时间t(min)的变化关系如右图所示。下列说法正确的是( )
| A.热量:Q(甲)<2Q(乙) |
| B.压强:p(甲)<2p(乙) |
| C.乙中前5 min内的反应速率v(O2)=0.10 mol·L-1·min-1 |
| D.保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2 mol O2、0.4 mol SO3,则此时v(正)<v(逆) |
将BaO2放入密闭的真空容器中,反应2BaO2(s) 2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
| A.平衡常数减小 | B.BaO量不变 | C.氧气压强不变 | D.BaO2量增加 |
已知图①~④的相关信息,下列相应叙述正确的是 ( )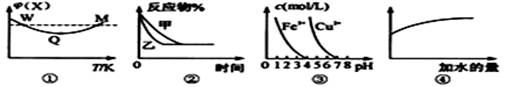
A.图①表示向恒容密闭容器中充入X和Y发生反应:2X(g)+Y(g)  3Z(g) △H﹤0,W点X的正反应速率等于M点X的正反应速率 3Z(g) △H﹤0,W点X的正反应速率等于M点X的正反应速率 |
B.图②表示压强对可逆反应A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强小 3C(g)+D(s)的影响,乙的压强比甲的压强小 |
| C.据图③,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至PH在4左右 |
| D.常温下,稀释0.1mol/LNa2CO3溶液,图④中的纵坐标可表示溶液中HCO3-的数目 |
下列图示与对应的叙述相符的是 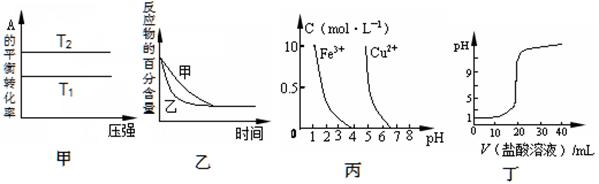
A.由图甲可以判断:若T1>T2,反应A(g)+ B(g) 2C(g)的△H<0 2C(g)的△H<0 |
B.图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 |
| D.图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化 |
升高温度,下列数据不一定同时增大的是 ( )
| A.化学反应速率v | B.弱电解质的电离平衡常数Ka |
| C.化学平衡常数K | D.水的离子积常数KW |
对于可逆反应2SO2+O2 2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子 ( )
2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子 ( )
| A.只存在于O2中 | B.只存在于O2和SO3中 |
| C.只存在于O2和SO2中 | D.存在于O2、SO2和SO3中 |
 I3-(aq)。在反应的平衡体系中,c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态)。
I3-(aq)。在反应的平衡体系中,c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态)。