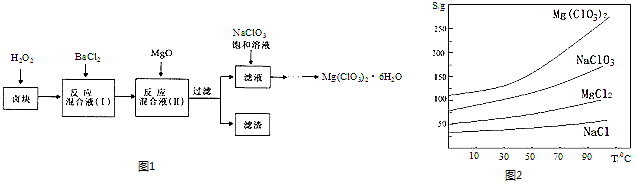
��Ŀ����
����Ŀ��������ĸ��ֻ��������ճ����������Ź㷺Ӧ�ã�������ѧ֪ʶ�ش��������⣺
��1����֪1g H2S������ȫȼ�գ�����Һ̬ˮ�Ͷ����������壬�ų�17.24kJ��������д��H2S����ȼ���ȵ��Ȼ�ѧ��ʽ�� ��
��2����֪��������NaHSO3��Һ��c��H2SO3 ����c��SO32���� ��H2SO3 �ĵ���ƽ�ⳣ��Ϊ��K1=1.5��10��2 K2=1.1��10��7����ˮ�ĵ���ƽ�ⳣ��ΪK=1.8��10��2�� ��i��������ʵ���Ũ�ȵ�����������Һ����NH3H2O ��KHSO3����KHCO3 ��Һ��ˮ�ĵ���̶��ɴ�С����˳��Ϊ
��ii��0.1molL��1��NaHSO3��Һ��C��H+��C��OH����������������������=������
��3����֪25��ʱKsp[Cu��OH��2]=2.2��10��20 �� Ksp[Fe��OH��2]=8.0��10��16 �� KspFe��OH��3]=4.0��10��38 �� Ksp[Al��OH��3]=1.1��10��33��i����25���£���Ũ�Ⱦ�Ϊ0.1mol/L��AlCl3��CuCl2�����Һ����μ��백ˮ���������������ѧʽ����
��ii����1.0mol Fe2��SO4��3��1.0mol FeSO4��1L���Ի����Һͨ��NH3 �� ������Һ��PHΪ3ʱ��������Һ��c��Fe2+����c��Fe3+��= ��
���𰸡�
��1��H2S��g��+ ![]() O2��g��=SO2��g��+H2O��l����H=��586.16 kJ?mol��1
O2��g��=SO2��g��+H2O��l����H=��586.16 kJ?mol��1
��2���ۣ��ڣ��٣���
��3��Al��OH��3��2.5��104
���������⣺��1��1gH2S�����ʵ���Ϊn= ![]() =
= ![]() =
= ![]() mol��ȼ������Һ̬ˮ�Ͷ�����������ʱ����17.24KJ����1molH2Sȼ�շ���586.16KJ�����Ȼ�ѧ����ʽΪ��H2S��g��+
mol��ȼ������Һ̬ˮ�Ͷ�����������ʱ����17.24KJ����1molH2Sȼ�շ���586.16KJ�����Ȼ�ѧ����ʽΪ��H2S��g��+ ![]() O2��g��=SO2��g��+H2O��l����H=��586.16 kJmol��1 �� ���Դ��ǣ�H2S��g��+
O2��g��=SO2��g��+H2O��l����H=��586.16 kJmol��1 �� ���Դ��ǣ�H2S��g��+ ![]() O2��g��=SO2��g��+H2O��l����H=��586.16 kJmol��1����2����i����NH3H2OΪ���������ˮ�ĵ��룬��Һ��������Ũ��С��c����ˮ�ĵ������Ƴ̶Ⱥܴ�KHSO3������Һ�е���������������ԣ����Ƶ�ˮ�ĵ��룬��Һ��������Ũ��ԶС��c����ˮ�ĵ�������Ƴ̶Ƚ�С����KHCO3����Һ��ˮ���Լ��ԣ��ٽ���ˮ�ĵ��룻����������Һ��ˮ�ĵ���̶��ɴ�С����Ϊ���ۣ��ڣ��٣����Դ��ǣ��ۣ��ڣ��٣���ii������NaHSO3��Һ�мȴ��ڵ���ƽ���ִ���ˮ��ƽ�⣺HSO3��H++SO32����HSO3��+H2OOH��+H2SO3 �� HSO3���ĵ���ƽ��̶ȴ�����ˮ��ƽ��̶ȣ�����Һ�����ԣ�C��H+������C��OH���������Դ��ǣ����� ��3����i������Al��OH��3��Cu��OH��2���ܶȻ���������25���£���Ũ�Ⱦ�Ϊ0.1molL��1��AlCl3��CuCl2�����Һ����μ��백ˮ��
O2��g��=SO2��g��+H2O��l����H=��586.16 kJmol��1����2����i����NH3H2OΪ���������ˮ�ĵ��룬��Һ��������Ũ��С��c����ˮ�ĵ������Ƴ̶Ⱥܴ�KHSO3������Һ�е���������������ԣ����Ƶ�ˮ�ĵ��룬��Һ��������Ũ��ԶС��c����ˮ�ĵ�������Ƴ̶Ƚ�С����KHCO3����Һ��ˮ���Լ��ԣ��ٽ���ˮ�ĵ��룻����������Һ��ˮ�ĵ���̶��ɴ�С����Ϊ���ۣ��ڣ��٣����Դ��ǣ��ۣ��ڣ��٣���ii������NaHSO3��Һ�мȴ��ڵ���ƽ���ִ���ˮ��ƽ�⣺HSO3��H++SO32����HSO3��+H2OOH��+H2SO3 �� HSO3���ĵ���ƽ��̶ȴ�����ˮ��ƽ��̶ȣ�����Һ�����ԣ�C��H+������C��OH���������Դ��ǣ����� ��3����i������Al��OH��3��Cu��OH��2���ܶȻ���������25���£���Ũ�Ⱦ�Ϊ0.1molL��1��AlCl3��CuCl2�����Һ����μ��백ˮ�� ![]() ��
�� ![]() �����Լ�����ͬ��Ũ�ȵİ�ˮ��Al��OH��3�������������Դ��ǣ�Al��OH��3����ii��pHΪ3ʱ��c��OH����=10��11mol/L����1.0mol FeSO4��Һ��c��Fe2+����c2��OH����=10��22��8.0��10��16 �� û�г������ɣ���c��Fe2+��=1.0mol/L����Ksp��Fe��OH��3��=4.0��10��38��֪��c��Fe3+��=
�����Լ�����ͬ��Ũ�ȵİ�ˮ��Al��OH��3�������������Դ��ǣ�Al��OH��3����ii��pHΪ3ʱ��c��OH����=10��11mol/L����1.0mol FeSO4��Һ��c��Fe2+����c2��OH����=10��22��8.0��10��16 �� û�г������ɣ���c��Fe2+��=1.0mol/L����Ksp��Fe��OH��3��=4.0��10��38��֪��c��Fe3+��= ![]() mol/L=4��10��5mol/L����c��Fe2+����c��Fe3+��=1��4��10��5=2.5��104�����Դ��ǣ�2.5��104 ��
mol/L=4��10��5mol/L����c��Fe2+����c��Fe3+��=1��4��10��5=2.5��104�����Դ��ǣ�2.5��104 ��

 ���ĺ����Ͼ�������ϵ�д�
���ĺ����Ͼ�������ϵ�д�����Ŀ�������£���0.05mol Na2CO3��������ˮ���100mL��Һ������Һ�м����������ʣ��йؽ�����ȷ���ǣ� ��
��������� | ���� | |
A | 50mL 1mol/L H2SO4 | ��Ӧ������c��Na+��=c��SO42���� |
B | 0.5mol CaO | ��Һ�� |
C | 50mL H2O | ��ˮ�������c��H+��c��OH�������� |
D | 0.1mol NaHSO4���� | ��Ӧ��ȫ����ҺpH��С��c ��Na+������ |
A.A
B.B
C.C
D.D