��Ŀ����
����Ŀ������þ[Mg��ClO3��2]����������������ݼ��ȣ�ʵ�����Ʊ�����Mg��ClO3��26H2O��������ͼ1�� 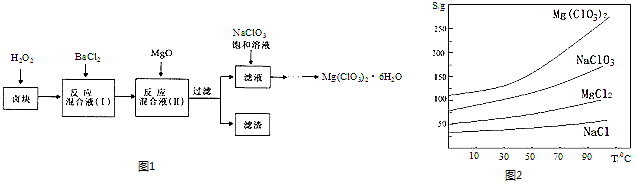
��֪����±����Ҫ�ɷ�ΪMgCl26H2O������MgSO4��FeCl2�����ʣ�
�����ֻ�������ܽ�ȣ�S�����¶ȣ�T��
�仯������ͼ2��ʾ���ش��������⣺
��1������ʱ��Ҫ�IJ��������� ��
��2������BaCl2��Ŀ���dz�ȥ�������ӣ������ѳ�����ȫ�ķ����� ��
��3������±����H2O2��Һ���ܽ�Ĵ�ʩ�У���д��һ�����ɣ�
��4������MgO���������� ��������Ҫ�ɷ�Ϊ ��
��5������Һ�м���NaClO3������Һ������Ӧ�Ļ�ѧ����ʽΪ��MgCl2+2NaClO3=Mg��ClO3��2��+2NaCl���ٽ�һ����ȡMg��ClO3��26H2O��ʵ�鲽������Ϊ�����ڳ��ȹ��ˣ������ܹ��ˡ�ϴ�ӡ����
��6����Ʒ��Mg��ClO3��26H2O�����IJⶨ�� ����1��ȷ����3.50g��Ʒ���100mL��Һ��
����2��ȡ10.00mL����ƿ�У�����10.00mLϡ�����20.00mL 1.000molL��1��FeSO4��Һ���ȣ�
����3����ȴ�����£���0��l000molL��1K2Cr2O7��Һ�ζ�ʣ���Fe2+���յ㣬�˹����з�Ӧ�����ӷ���ʽΪ��Cr2O72��+6Fe2++14H+=2Cr3++6Fe3++7H2O��
����4��������2��3�ظ����Σ������ƽ������K2Cr2O7��Һ15.00mL��
����д������2�з�����Ӧ�����ӷ���ʽ����ԭ����ΪCl����
�ڲ�Ʒ��Mg��ClO3��26H2O����������Ϊ �� ��������������λС����
���𰸡�
��1��©�������������ձ�
��2�����ã�ȡ�ϲ���Һ����BaCl2 �� ���ް�ɫ��������SO42��������ȫ
��3����±��������ȵ�
��4��������Һ��pH��ʹFe3+������ȫ��BaSO4��Fe��OH��3
��5������Ũ������ȴ�ᾧ
��6��ClO3��+6Fe2++6H+=6Fe3++Cl��+3H2O��78.31%
���������⣺��1������ʵ���õ���������©�������������ձ�����ֽ������̨�ȣ����в��������У�©�������������ձ��� ���Դ��ǣ�©�������������ձ�����2����������������Ƿ�����ķ��������ã�ȡ�ϲ���Һ����BaCl2 �� ���ް�ɫ��������SO42��������ȫ����������þ��������Һ��pHΪ4����ʱ�������γ��˳��������������������Ѿ������������ֻ�Ӧ���������ᱵ������
���Դ��ǣ����ã�ȡ�ϲ���Һ����BaCl2 �� ���ް�ɫ��������SO42��������ȫ����3��Ӱ�컯ѧ��Ӧ���ʵ������У������¶ȡ�����������ϸС�Ŀ������������ʵ�Ũ�ȵȣ���˼���±����KMnO4��Һ���ܽ�Ĵ�ʩ�У���±��������ȵȣ�
���Դ��ǣ���±��������ȵȣ���4������������MgO�����ᷴӦ�����κ�ˮ�����Լ���MgO�������ǵ�����Һ��pH��ʹ����Fe3+�γɳ�����ȫ��ȥ������ʾ��ͼ��֪��������Ҫ�ɷ�ΪBaSO4��Fe��OH��3 ��
���Դ��ǣ�������Һ��pH��ʹFe3+������ȫ��BaSO4��Fe��OH��3����5������NaCl��Mg��ClO3��2���ܽ�����¶ȵĹ�ϵ����Һ����Ũ�������ȹ��ˡ���ȴ�ᾧ�������ˡ�ϴ�ӣ��͵õ�Mg��ClO3��26H2O��
���Դ��ǣ�����Ũ������ȴ�ᾧ����6������������Ӿ��������ԣ����Խ�������������Ϊ�����ۣ����ӷ���ʽΪClO3��+6Fe2++6H+=6Fe3++Cl��+3H2O�����Դ��ǣ�ClO3��+6Fe2++6H+=6Fe3++Cl��+3H2O���ڸ��ݻ�ѧ����ʽ��ClO3��+6Fe2++6H+=6Fe3++Cl��+3H2O�Լ�Cr2O72��+6Fe2++14H+�T2Cr3++6Fe3++7H2O�����Եó���ClO3����6Fe2+ �� Cr2O72����6Fe2+ �� ��0.100molL��1 K2Cr2O7��Һ�ζ����յ���̿��Եó�ʣ����������ӵ����ʵ���Ϊ��0.100molL��1��0.015L��6=0.009mol������������ӷ�Ӧ���������ӵ����ʵ���Ϊ��20��10��3L��1.000molL��1��0.009mol=0.011mol����������ӵ����ʵ���Ϊ ![]() ��0.011mol����Ʒ��Mg��ClO3��26H2O��������������
��0.011mol����Ʒ��Mg��ClO3��26H2O�������������� ![]() ��0.011��299g/mol����10��
��0.011��299g/mol����10�� ![]() ��100%=78.31%��
��100%=78.31%��
���Դ��ǣ�78.31%��

 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�