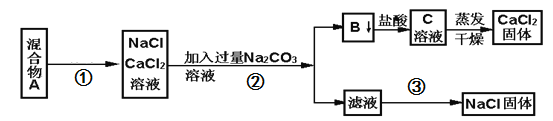
题目内容
【题目】根据反应Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
(1)氧化产物是__________,还原产物是________。
(2)氧化剂与还原剂的物质的量之比是________。
(3)当有2 mol HNO3参加反应时,被氧化的物质是_____________ mol ,电子转移数目约为________个。
【答案】Cu(NO3)2NO22:10.56.02x1023
【解析】(1)Cu失去电子被氧化,则Cu(NO3)2为氧化产物,N得到电子被还原,则NO2为还原产物;
(2)Cu元素的化合价升高,N元素的化合价降低,则HNO3为氧化剂,Cu为还原剂,且反应中HNO3一半作氧化剂,由反应可知氧化剂与还原剂的物质的量之比是2∶1;
(3)当有2mol HNO3参加反应时,被氧化的物质是Cu,其质量为2mol×![]() =0.5 mol,电子转移数目约为2mol×
=0.5 mol,电子转移数目约为2mol×![]() ×(2-0)×6.02×1023=6.02×1023。
×(2-0)×6.02×1023=6.02×1023。

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目