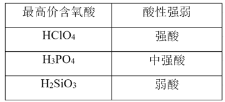
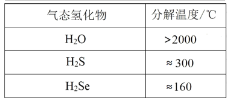
题目内容
【题目】高温下CO2和H2S发生如下反应:CO2(g) +H2S(g)COS(g) +H2O(g)。有关实验数据如下:
实验 | 温度 | 物质的起始物质的量/(mol) | 平衡时COS物质的量/(mol) | |
n(CO2) | n(H2S) | n(COS) | ||
I | 337℃ | 0.10 | 0.40 | 0.01 |
II | 347℃ | 0.10 | 0.40 | 0.015 |
下列说法不正确的是
A.该反应为吸热反应
B.实验I达平衡后COS的物质的量分数为5%
C.实验I温度下,反应的平衡常数为![]()
D.平衡后向II中再充入0.10 mol CO2和0.40 mol H2S,相同温度下再达平衡时n(COS)=0.03mol
【答案】B
【解析】
A.根据表中数据可知,当二氧化碳和硫化氢的起始物质的量相同时,温度越高,COS的物质的量越大,说明温度越高,平衡向着吸热的方向移动,即COS的物质的量增大的方向为吸热的方向,正反应为吸热反应,故A正确;
B.根据实验I,写出反应三段式,
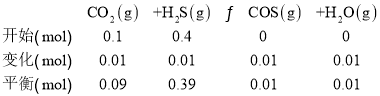
平衡后COS的物质的量分数=![]() ,故B错误;
,故B错误;
C.根据B项分析,反应的平衡常数为![]() ,故C正确;
,故C正确;
D.根据题意,列三段式:
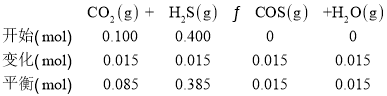
![]() , 平衡后向II中再充入0.10 mol CO2和0.40 mol H2S,设转变的二氧化碳的物质的量为x,
, 平衡后向II中再充入0.10 mol CO2和0.40 mol H2S,设转变的二氧化碳的物质的量为x,
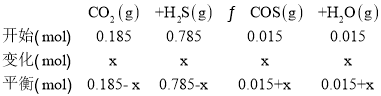
![]() ,x=0.015mol,相同温度下再达平衡时n(COS)=0.015mol+0.015mol=0.03mol,故D正确;
,x=0.015mol,相同温度下再达平衡时n(COS)=0.015mol+0.015mol=0.03mol,故D正确;
答案选B。

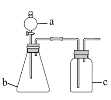
【题目】用如图所示的装置进行实验(夹持及尾气处理仪器略去),能达到实验目的的是
选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 | 装置 |
A | 氨水 | CaO | 无 | 制取并收集氨气 |
|
B | 浓盐酸 | MnO2 | 饱和NaCl溶液 | 制备纯净的Cl2 | |
C | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 比较酸性强弱: H2CO3>H2SiO3 | |
D | 浓硫酸 | Na2SO3 | KMnO4酸性溶液 | 验证SO2具有还原性 |
A.AB.BC.CD.D